Now Reading: Tümör Mikroçevresinde Uzun Kodlamayan RNA’ların Kanser İlerlemesindeki Rolü
-
01
Tümör Mikroçevresinde Uzun Kodlamayan RNA’ların Kanser İlerlemesindeki Rolü
Tümör Mikroçevresinde Uzun Kodlamayan RNA’ların Kanser İlerlemesindeki Rolü
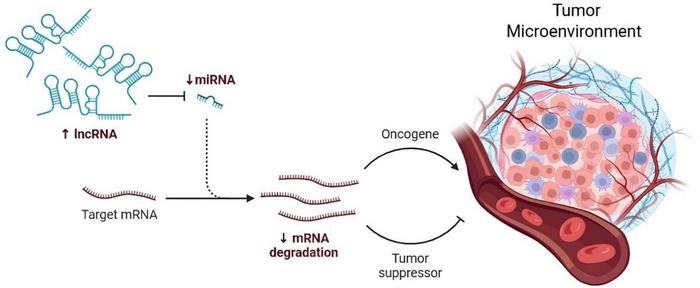
Kanser biyolojisinde tümör mikroçevresi (TME) ve uzun kodlamayan RNA’ların (lncRNA’lar) önemi giderek daha fazla gündeme gelmektedir. 200 nükleotid üzerinde uzunluğa sahip, ancak protein kodlamayan bu RNA molekülleri, geçmişte yalnızca genetik “gürültü” olarak görülürken, günümüzde gen ekspresyonundan, hücreler arası sinyalleşmeye kadar birçok kritik işlevde rol oynadığı bilinmektedir. Uzun kodlamayan RNA’lar tümör hücreleri ile çevrelerindeki stromal ve bağışıklık hücreleri arasındaki karmaşık etkileşimleri düzenleyerek, kanserin ilerlemesini ve tedaviye direncini şekillendirir. Bu moleküller, bağışıklıktan kaçış, anjiyogenez, metastaz ve tedavi direnci gibi süreçlerde etkili olup, kanser araştırmalarında yeni ufuklar açmaktadır.
Tümör mikroçevresi, kanser hücreleri, fibroblastlar, bağışıklık hücreleri, ekstraselüler matriks (ECM) bileşenleri ve sitokinler gibi çözünür faktörlerin bir arada bulunduğu karmaşık bir ekosistemdir. Bu yapıda lncRNA’lar, farklı hücre tipleri arasındaki iletişimi koordine eder ve tümörün gelişimini destekleyen moleküler ortamı şekillendirir. Transkripsiyonel, post-transkripsiyonel ve epigenetik düzeylerde işlev gören bu RNA’lar, kromatin yapısının yeniden şekillenmesi, mRNA stabilitesi ve protein sentezinin düzenlenmesi gibi mekanizmalarla tümörün hayatta kalma ve çoğalma sinyallerini ince bir şekilde modüle eder.
TME içerisinde lncRNA’ların kritik rollerinden biri de, özellikle tümör ilişkili fibroblastlar (TAF’lar) aracılığıyla stromal-tümör arası iletişimi kontrol etmeleridir. Tümör kaynaklı sinyaller tarafından yeniden programlanan bu fibroblastlar, ECM’nin yeniden şekillenmesi, bağışıklık ortamının düzenlenmesi ve büyüme faktörlerinin salgılanması gibi işlevlerle tümör progresyonunu destekler. Örneğin, oral skuamöz hücreli karsinomda LOC100506114 adlı lncRNA, fibroblastların aktivasyonunu tetikleyerek bunların tümörü destekleyici etkisini artırmaktadır. Benzer şekilde, MALAT1’in TAF’larda aşırı ekspresyonu, çevresindeki tümör hücrelerinin invazivlik ve göç kabiliyetini yükseltmektedir.
LncRNA’lar bağışıklık hücrelerinin fonksiyonlarını da derinlemesine etkileyerek, tümörün bağışıklık sisteminden kaçmasına olanak tanıyan immün supresif bir mikroçevre oluştururlar. Bağışıklık kontrol noktalarını ve sitokin üretimini düzenleyerek, HISLA gibi lncRNA’lar tümör ilişkili makrofajların metabolizmasını glikolize kaydırıp, kanser hücrelerinin anti-apoptotik yollarını destekler. Ayrıca NEAT1 ve MALAT1 gibi lncRNA’lar, T hücrelerinin fonksiyonlarını engelleyerek bağışıklık yanıtını zayıflatır ve tümörün kalıcılığını kolaylaştırır.
Anjiyogenez, yani yeni kan damarlarının oluşumu, tümörlerin büyümesi ve metastazı için hayati önem taşır. LncRNA’lar, hem tümör hem de endotel hücrelerinde anjiyojenik sinyal yollarını düzenleyerek bu süreci destekler. Örneğin, meme kanserinde NR2F1-AS1 adlı lncRNA, endotel hücre belirteçleri CD31 ve CD34 ile pozitif korelasyon göstererek vasküler dallanmayı teşvik eder. Gastrik kanserde PVT1 lncRNA’sı ise VEGFA ekspresyonunu artırarak anjiyogenez hızını yükseltmektedir. Bu lncRNA’ların hedeflenmesi, tümörleri besleyen damar ağının yıkımı için önemli bir strateji oluşturmaktadır.
Tümör mikroçevresinde hücreler arası iletişim, ekzosom gibi ekstraselüler veziküllerin taşıdığı lncRNA’larla daha karmaşık bir hale gelmiştir. Kanser hücreleri ve stromal hücreler, bu veziküller aracılığıyla biyolojik moleküller alışverişinde bulunur. Örneğin, tümör ilişkili makrofajlardan gastrik kanser hücrelerine ekzosomla geçen CRNDE lncRNA’sı, tümör baskılayıcı gen PTEN’in yıkımını sağlayarak tümör hücrelerinin hayatta kalmasını ve kemoterapi direncini artırır. Bu yatay lncRNA transferi, tümörün mikroçevresini kendi lehine şekillendirerek tedavi direncini tetikler.
Konvansiyonel kanser tedavilerine direnç ise günümüzde en büyük zorluklardan biridir ve lncRNA’ların bu direnç mekanizmalarında merkezi bir rolü olduğu ortaya çıkmıştır. Örneğin, yemek borusu kanserindeki DNM3OS lncRNA’sı, kanser ilişkili fibroblastlarda artmış şekilde bulunur ve DNA hasar yanıtını güçlendirerek radyoterapi direncini artırır. Ayrıca lncRNA’lar, ilaç taşıyıcı proteinlerin, anti-apoptotik faktörlerin ve tedavi kaçış yollarının gen ekspresyonunu düzenleyerek kanser hücrelerinin tedaviye karşı avantaj sağlamasını kolaylaştırır.
LncRNA’ların klinik ölçüde önemi yalnızca işlevleriyle sınırlı kalmayıp, aynı zamanda tanı ve prognoz belirleyiciler olarak da önemli potansiyel taşımaktadır. Doku özgüllükleri ve vücut sıvılarında yüksek stabiliteleri sayesinde, non-invaziv yöntemlerle kanser tespiti için ideal biyobelirteç adaylarıdır. Özellikle dolaşımdaki ekzosomal lncRNA’lar, tümörün mevcut durumunun dinamik göstergesi olarak erken tanı ve tedavi yanıtlarının izlenmesinde önemli avantajlar sağlar.
Ancak lncRNA’lara yönelik hedefe yönelik tedavi stratejileri henüz emekleme aşamasındadır. Bu moleküllerin farklı işlev modları, bağlam bağımlılığı ve yapısal karmaşıklığı, etkili modülasyonunu zorlaştırmaktadır. Antisens oligonükleotidler (ASO), RNA interferansı (RNAi) ve CRISPR-Cas tabanlı gen düzenleme teknikleri gibi yöntemler geliştirilmektedir ancak tümöre özgü ve etkili taşıyıcı sistemlerin geliştirilmesi kritik bir gerekliliktir. Nanoteknolojideki ilerlemeler, hedefe yönelik ve off-target etkileri minimize eden taşıyıcıların ümit vadeden örneklerini sunmaktadır.
Araştırmalar devam ettikçe, lncRNA’ların TME’deki rolleri daha ayrıntılı şekilde ortaya konmaktadır. Epitel-mesenkimal transformasyon (EMT), metabolik yeniden programlama ve kanser kök hücresi sürdürümü gibi kritik süreçlerdeki regülasyonları, tümörün agresifliği ve metastatik potansiyelini şekillendirir. Çoklu omik ve tek hücre teknolojilerinin entegrasyonu, lncRNA işlevlerinin bağlamsal koşullara göre değişimini aydınlatarak daha hedeflenmiş ve kişiselleştirilmiş terapi yaklaşımlarının geliştirilmesini sağlayacaktır.
Onkoloji alanı, lncRNA’ların sunduğu bu yeni bilimsel perspektifle tedavi etkinliğini artırmak üzere mevcut yöntemlerle kombine yaklaşımlara yönelmektedir. Kemoterapi, radyoterapi ve immünoterapi gibi klasik tedavilere lncRNA hedeflemesinin eklenmesi, tümörü koruyan mikroçevresel bariyerlerin yıkılmasına katkı sağlayabilir. Bu çok yönlü strateji, tümör mikroçevresinin RNA düzeyindeki düzenlenmesi ile kanser yönetiminde hastalık seyrini değiştiren yeni bir dönemin habercisidir.
Sonuç olarak, tümör mikroçevresinde uzun kodlamayan RNA’ların keşfi, kanser biyolojisinde paradigmayı kökten değiştirmektedir. Bu moleküller hem tümör ilerlemesini yöneten merkezi düzenleyiciler hem de klinik olarak hedeflenebilir biyobelirteçler olarak önem taşımaktadır. Moleküler biyoloji, genomik, biyoinformatik ve nanomedisin alanlarının disiplinlerarası iş birliğiyle lncRNA’ların potansiyelinden tam anlamıyla yararlanmak mümkün olacak ve yenilikçi, etkili, kişiye özel kanser tedavilerinin yolu açılacaktır.
—
**Araştırma Konusu**:
Long non-coding RNAs in tumor microenvironment regulation and cancer progression
**Makale Başlığı**:
Tumor Microenvironment Dynamics: The Regulatory Influence of Long Non-coding RNAs
**Haberin Yayın Tarihi**:
22-Feb-2025
**Web References**:
Gene Expression Journal
**Doi Referans**:
10.14218/GE.2024.00069
**Resim Credits**:
Ilgiz Gareev, Ozal Beylerli
**Anahtar Kelimeler**:
Long noncoding RNA, Primary tumors, Tumor cells, Molecular targets, Tumor microenvironments