Now Reading: Sigara ile İlişkili Yaygın Akciğer Kanserinin Kökenleri Belirlendi
-
01
Sigara ile İlişkili Yaygın Akciğer Kanserinin Kökenleri Belirlendi
Sigara ile İlişkili Yaygın Akciğer Kanserinin Kökenleri Belirlendi
Akciğer kanserleri arasında dünyada ikinci en yaygın tür olan skuamöz hücreli akciğer kanserinin (LUSC) hücresel kökenleri ve erken gelişim süreçlerine dair çok önemli bulgular bir araştırma ile gün yüzüne çıktı. University College London (UCL), Wellcome Sanger Enstitüsü ve Cambridge Üniversitesi’nden oluşan disiplinlerarası bir ekip tarafından yürütülen çalışma, soluk borusundaki belirli bir bazal kök hücre popülasyonunun anormal biçimde çoğalarak kanserleşme sürecine öncülük ettiğini ortaya koydu. Bu önemli gelişme, akciğer kanserinde erken tanı ve korunma amaçlı stratejilerin geliştirilmesi adına umut verici bir zemin hazırlıyor.
Skuamöz hücreli akciğer kanseri genellikle tütün dumanı başta olmak üzere uzun süreli zararlı madde solunumu sonucunda ortaya çıkar. Bu maruziyet, solunum yollarındaki epitel hücrelerinde birikimli genetik hasara neden olur. Ancak, sağlıklı epitel dokudan kanser öncesi lezyonlara geçiş sürecine dair özgül hücresel dinamikler ve moleküler olaylar uzun zamandır tam olarak aydınlatılamamıştı. Bu çalışma, Krt5 genini ifade eden bazal hücrelerde klonal bir çoğalma yaşandığını ve bu hücrelerin dokudaki yapısal bütünlük için kritik bir protein ürettiğini ortaya koydu.
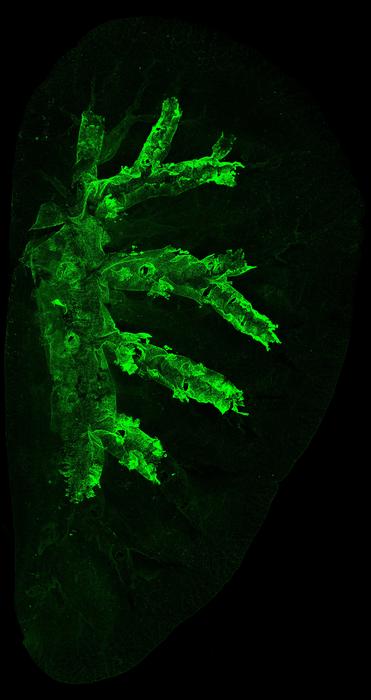
Araştırmacılar, genetik olarak modifiye edilmiş fare modellerinde Krt5-pozitif bazal hücreleri floresan ışığında işaretleyerek bu hücreleri ve türevlerini detaylı bir şekilde takip ettiler. Kanserojenlere maruz kalan farelerde, bazal hücrelerin küçük bir alt kümesinin aşırı çoğaldığı ve trakeadan daha derin akciğer dokusuna doğru invazyon yaparak normal hücreleri yerinden ettiği gözlemlendi. Karşıt olarak, kanserojene maruz kalmayan kontrol farelerinde bazal hücre popülasyonları stabil kalmış ve kendi doğal konumlarında sınırlı kalmıştı.
Tek hücre RNA dizilemesi (single-cell RNA sequencing) analizleri, patolojik bazal hücre çoğalması sırasında hava yollarındaki hücresel bileşimde belirgin değişiklikler olduğunu ortaya koydu. Özellikle Krt13 geniyle işaretlenen geçiş evresindeki hücrelerin ortaya çıktığı, bazı farklılaşmış luminal hücre türlerinin ise azaldığı tespit edildi. Bu dengesizlik, normal hava yolu işlevlerinin korunması için kritik olan hücresel dengeyi bozarak, kanser başlangıcı için elverişli bir mikroçevre oluşumunu işaret ediyor.
Fare modelinden elde edilen bulguları destekleyen insan doku analizlerinde, özellikle tütün dumanına maruz kalmış güncel ve eski sigara içicilerden alınan akciğer ile trakea dokularında, birden fazla kanser öncesi lezyonun klonal olarak ilişkili olduğu belirlendi. Bu durum, tek bir hasarlı bazal hücrenin köken aldığı ve akciğer dokusu içine yayılarak bağımsız tümör odaklarının oluştuğu hipotezini güçlendirdi. Böylece bazal hücrelerin LUSC gelişiminde kritik “hücre kökeni” olduğu netleşti.
Bu kritik keşifler sadece hücresel kaynakların belirlenmesiyle kalmıyor; kanserojen baskısı altında hava yollarının yeniden şekillenmesini yöneten klonal dinamikler ve hücresel hiyerarşiler anlam kazanıyor. Tümör oluşturucu bazal hücreler, genetik çeşitliliği ve kontrolsüz çoğalmayı destekleyen özel çevresel ve moleküler alanları akciğer epiteli içerisinde kullanıyorlar. Zamanla bu süreç, kontrolsüz doku büyümesi ve tümör oluşumuna zemin hazırlıyor.
Klinik açıdan bu anormal bazal hücre klonlarının ve ilişkili hücresel imzaların tanımlanması, hastalığın erken evrede yakalanabilmesi için büyük fırsatlar sunuyor. Günümüzde akciğer kanseri teşhisleri genellikle ileri evrelerde konulmakta; bu nedenle tedavi seçenekleri sınırlı ve yaşam süreleri kısadır. Ancak kanser öncesi hücresel durumların ve moleküler belirteçlerin tanımlanması, invaziv olmayan tarama yöntemleriyle risk altındaki kişilerin erken saptanmasına olanak tanıyabilir.
Ayrıca çalışma, bazal hücrelerin klonal çoğalmasının düzenlenmesi ve epitel dengesinin yeniden sağlanmasına yönelik yeni önleyici tedavi yöntemlerinin geliştirilmesi için de kapılar açıyor. Bazal hücre baskınlığını tetikleyen sinyal yollarını modüle etmek veya koruyucu luminal hücrelerin hayatta kalmasını desteklemek, kanserleşme sürecini kökten engelleyebilir. Bu yaklaşımlar özellikle kronik sigara içicileri gibi yüksek risk gruplarında uzun vadede hastalığın seyri üzerinde etkili olabilir.
Uzmanlar, genetik faktörler ile akciğer mikroçevresi arasındaki karmaşık etkileşimin tam olarak anlaşılmasının önemini vurguluyor. Bazal hücrelerin çoğalmasını mümkün kılan “izin veren” çevre alanları, sadece genetik mutasyonlardan değil, aynı zamanda dokunun üç boyutlu organizasyonu ve moleküler sinyallerle şekilleniyor. Bu çok yönlü etkileşimin hedef alınması, tümör başlangıcı ve ilerlemesinin engellenmesi yönünde yeni nesil tedavi stratejileri için temel bir yaklaşım sunuyor.
Bu çalışma aynı zamanda experimental fare modelleri, tek hücre transkriptomikleri ve yüksek çözünürlüklü insan doku genetik analizlerinin birlikte kullanılmasının hastalık mekanizmalarının çözümünde ne denli güçlü olduğunu kanıtlıyor. LUSC hastalığını tetikleyen ilk hücresel olayların ayrıntılı biçimde ortaya konması, kanser biyolojisine yönelik önemli bir adım olarak kabul ediliyor. Dünya genelinde akciğer kanserinin yol açtığı büyük sağlık yükü göz önünde bulundurulduğunda, böylesi temel bilimsel bulgular erken tanı, hasta sağkalımı ve hastalık önleme alanlarında yeni ufuklar açıyor.
Sonuç olarak trakeadaki Krt5-ekspresyonu gösteren bazal hücrelerin LUSC’nin hücre kökeni olarak tanımlanması, akciğer kanserinin gelişim süreci hakkında önemli bilgiler sunuyor. Bu hücrelerin klonal olarak nasıl hakim hale geldiği ve hava yollarını nasıl şekillendirdiğine dair detaylı betimlemeler, hem araştırma hem de klinik uygulama alanlarında yeni yaklaşımların doğmasına zemin hazırlıyor. Bu alandaki devam eden çalışmalar, elde edilen temel bilgiyi pratik sağlık faydalarına dönüştürmede kritik öneme sahip olacak ve en ölümcül kanser türlerinden biri olan LUSC tedavisinde çığır açabilir.
—
**Araştırma Konusu**: Animals
**Makale Başlığı**: Aberrant basal cell clonal dynamics shape early lung carcinogenesis
**Haberin Yayın Tarihi**: 1-May-2025
**Web References**: http://dx.doi.org/10.1126/science.ads9145
**Resim Credits**: UCL
**Anahtar Kelimeler**: Cancer, Squamous cell lung cancer