Now Reading: RANBP2: Solid Tümörlerde Kritik Rol ve Terapötik Hedef Olarak Potansiyeli
-
01
RANBP2: Solid Tümörlerde Kritik Rol ve Terapötik Hedef Olarak Potansiyeli
RANBP2: Solid Tümörlerde Kritik Rol ve Terapötik Hedef Olarak Potansiyeli
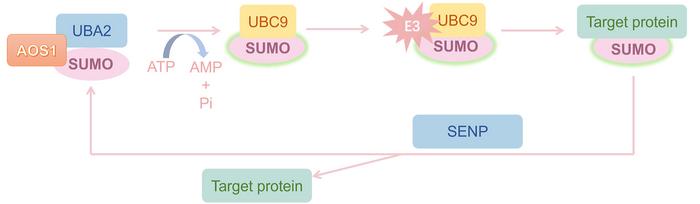
Son dönemde kanser biyolojisi alanında önemli bir mercek altına alınan nükleer pore kompleksi proteini RANBP2, SUMO E3 ligaz olarak oynadığı kritik rol sayesinde SUMOylasyon adı verilen post-translasyonel modifikasyon süreçlerinde merkezi bir aktör olarak tanımlanıyor. Bu biyokimyasal süreç, Küçük Ubiquitin-benzeri Modifikasyon (SUMO) proteinlerinin hedef moleküllere kovalent şekilde bağlanmasını içerirken, hücre işlevlerinin düzenlenmesinde protein stabilitesi, lokalizasyonu ve aktivitesi üzerinde derin etkiler yaratıyor. RANBP2’nin özellikle hücre döngüsündeki düzenleyici işlevi, solid tümörlerin patogenezinde ortaya koyduğu kritik etkilerle birlikte biyomedikal araştırmalarda ön plana çıkarak, tümör biyolojisinin önemli bir düğüm noktası haline gelmesini sağladı.
SUMOylasyon mekanizması, yapısal ve işlevsel açıdan ubiquitinasyona benzerlik gösterse de, moleküler düzeyde birçok onkogen ve tümör süpresörünü kontrol eden özel bir anahtar görevi görüyor. RANBP2’nin nükleer pore kompleksi içerisinde yer alması, yalnızca çekirdek-sitoplazma arası trafiğin sağlanması açısından değil, aynı zamanda mitotik süreçlerin yüksek doğrulukla ilerlemesinin denetlenmesi açısından da vazgeçilmez. Bu çift yönlü işlevsellik, RANBP2’nin hücresel homeostazı etkileyebilme kapasitesini artırırken, düzensizlik halinde onkogenik dönüşümü tetikleyebilecek karmaşık bir mekanizmaya erişmesini mümkün kılıyor. Son araştırmalar, RANBP2’nin hepatoselüler karsinom, mide ve meme kanseri gibi çeşitli kanser türlerinde çok boyutlu roller üstlendiğini ortaya koyarak, tümör biyolojisinde bir moleküler mihenk taşı olarak kabul edilmesini sağladı.
Hepatoselüler karsinomda (HCC), RANBP2’nin LASP1 adlı, sitoskeletal dinamikleri ve hücresel hareketliliği düzenleyen proteini SUMOylasyonu yoluyla modüle ettiği görülüyor. Bu modifikasyon, HER2 ekspresyonunun artmasına yol açarak, kontrolsüz proliferasyon ve tümör büyümesini destekleyen bir mikroçevre yaratıyor. Ayrıca, RANBP2’nin transkripsiyon faktörü NR5A2 üzerindeki etkileri alfa-fetoprotein seviyelerinde değişimlere neden olup, klinik tanıda önemli bir biyobelirteç olan bu proteinin regülasyonunu etkiliyor. RANBP2’nin IL-33 proteinini SUMOylaması ise, HCC hücrelerinin bağışıklıktan kaçış stratejilerine katkı sağlayan sofistike bir mekanizma sunuyor.
Safra yolu kanserlerinden biri olan kolanjiyokarsinomda da anormal RANBP2 aktivitesi gözlemleniyor. Burada RANBP2’nin p27kip1 proteinine uyguladığı SUMOylasyon, bu proteinin nükleusa taşınmasına sebep oluyor. Nükleer lokalizasyona geçen p27kip1, normalde hücre döngüsünü durduran bir kinaz inhibitörü olmakla birlikte, bu modifikasyon sayesinde fonksiyonunu yitirerek kanser hücre proliferasyonunu teşvik ediyor. Bu durum, RANBP2’nin aracılık ettiği post-translasyonel değişikliklerin geleneksel tümör süpresör mekanizmalarını nasıl tersine çevirebileceğini gözler önüne seriyor.
Mide kanserinde, RANBP2’nin DAXX isimli ölüm domaini içeren proteine olan etkileşimi öne çıkıyor. Bu etkileşimle birlikte DAXX’ın nükleer lokalizasyonu artmakta ve bu durum, kötü prognoz ile agresif tümör fenotipleriyle korelasyon göstermektedir. DAXX’ın nükleus içerisindeki fonksiyonları arasında transkripsiyon regülasyonu ve kromatin remodelasyonu bulunurken, RANBP2 aracılığıyla güçlendirilen SUMOylasyon imzaları mide karsinomunda epigenetik düzensizliklerin temelini oluşturuyor.
Meme kanserinde RANBP2’nin oluşturduğu SUMOylasyon ortamı da kanserin gelişiminde önemli rol oynuyor. Burada β-arrestin 2 proteininin modifikasyonu, genom stabilitesi ve apoptozda merkezî rol oynayan MDM2-p53 sinyal ekseninin bozulmasına neden oluyor. İlginç bir şekilde, bu bozulma p53 aktivitesinin artmasına ve dolayısıyla tümör baskılayıcı etkilerin ortaya çıkmasına yol açıyor. Bu durum, RANBP2’nin hücre bağlamına ve substrat tercihlerine bağlı olarak tümör büyümesini sınırlama potansiyeline sahip ikili bir fonksiyon sergileyebileceğine işaret ediyor.
Rahim ağzı kanserinde ise RANBP2, TCF4’ün transkripsiyonel aktivitesini SUMOylasyon ile artırarak Wnt/β-katenin sinyal yolunu aktive ediyor. Bu sinyal mekanizması, hücre proliferasyonu, invazyonu ve metastazı tetikleyen bilinen önemli bir yol olduğu için, RANBP2’nin bu biyokimyasal modifikasyonları tümör ilerleyişinde hayati bir rol üstleniyor.
Prostat kanserinde RANBP2, p53 SUMOylasyon durumunu modüle ederek androjen reseptörü aracılı sinyal yollarını etkiliyor. Androjen reseptörünün hastalığın biyolojisindeki merkezi rolü göz önüne alındığında, RANBP2’nin bu eksendeki düzenleyici fonksiyonu, kanser hücre proliferasyonu ve hayatta kalmasını belirgin biçimde etkiliyor. Bu durum, RANBP2 ve ilgili yolların hedeflenmesinin terapötik fayda sağlayabileceğini gösteriyor.
Glioblastomda, yaşam süresi bakımından prognosis açısından olumsuz tablo çizen bir beyin tümöründe, RANBP2 aracılı SUMOylasyonun DNA tamir ve kromatin reorganizasyon mekanizmalarına etkileri ortaya konuyor. Genom stabilitesinin korunmasında kritik rol oynayan bu süreçler, tümör hücrelerinin hayatta kalması için önemli bir zafiyet noktası teşkil edebilir.
RANBP2’nin etkileri yalnızca bu kanser türleriyle sınırlı kalmıyor. Oral ve kolorektal kanserlerde de rol üstlendiği belirtiliyor. Özellikle kolorektal karsinomda, RANBP2 yetersizliği mitotik iğ iplikçiklerinin stabilitesini bozarak apoptozu tetikliyor ve tümör büyümesini engelliyor. Ayrıca, akciğer kanserinde RANBP2’nin DNA Topoizomeraz II ile etkileşimi, genetik bütünlüğün korunması ve hızlı tümör hücresi proliferasyonunun sürdürülmesinde geniş kapsamlı işlevlere işaret ediyor.
RANBP2’nin çeşitli moleküler etkileşimleri ve düzenleyici işlevlerinin toplamı, onu terapötik hedefler açısından cazip bir molekül haline getiriyor. Ancak, bu SUMO E3 ligazının etkilediği karmaşık moleküler ağların çözülmesi ve bağlam bağımlı etkilerinin ayrıştırılması, seçici inhibitörlerin geliştirilmesinde kritik öneme sahip. Böylece, kanser hücrelerindeki oncogenic zafiyetlerden faydalanılarak, sağlıklı hücrelerin vital fonksiyonlarının bozulmasının önüne geçilebilecektir.
Post-translasyonel modifikasyonları hedef alan tedavi yaklaşımları, kanser terapötiklerinde bir çığır açarak, tümör hücrelerinin temel moleküler mekanizmalarını doğrudan hedef alan kişiselleştirilmiş tedavi stratejilerinin gelişmesine olanak sağlıyor. Farklı tümör mikroçevrelerinde şekillenen SUMOylasyon profillerinin çözümlenmesi ile birlikte, RANBP2, kanser ilerlemesini engelleyebilir ve klinik sonuçları iyileştirebilecek yeni ilaç geliştirme stratejilerinde öne çıkan adaylardan biri haline geliyor.
Moleküler onkoloji ve fonksiyonel proteomik alanındaki hızlı ilerlemeler, RANBP2’nin hedef aldığı substratların ve bunların downstream sinyal yolaklarının tüm setinin tanımlanmasını zorunlu hale getiriyor. Bu derinlemesine bilgi birikimi, SUMOylasyon modülatörlerinin ve kombinasyon terapilerinin tasarımını kolaylaştıracak ve RANBP2’nin yönettiği kanser destekleyici döngülerin etkili biçimde kesintiye uğratılmasını mümkün hale getirecektir.
Sonuç olarak, nükleer pore kompleksinde merkezi bir SUMO E3 ligaz olarak görev yapan RANBP2, hücre döngüsü kontrolü, protein lokalizasyonu ve gen ekspresyon düzenlemesi alanlarında birçok tümörojenik sürecin kavşağında yer alıyor. Çok sayıda solid malignitedeki çok yönlü etkileşimleri, RANBP2’yi hem biyobelirteç hem de terapötik hedef olarak ön plana çıkarıyor. Bu moleküler anlayışların klinik uygulamalara dönüştürülmesi, pek çok agresif kanser ile mücadelede tedavi paradigmalarını önemli ölçüde değiştirebilir.
Araştırma Konusu:
Nükleer pore kompleksi proteini RANBP2 ve SUMOylasyonun solid kanserlerdeki rolü.
Makale Başlığı:
Nuclear pore complex protein RANBP2 and related SUMOylation in solid malignancies.
Web References:
http://dx.doi.org/10.1016/j.gendis.2024.101407
Doi Referans:
10.1016/j.gendis.2024.101407
Resim Credits:
Genes & Diseases
Anahtar Kelimeler:
RANBP2, SUMOylasyon, nükleer pore kompleksi, solid maligniteler, hepatoselüler karsinom, mide kanseri, meme kanseri, rahim ağzı kanseri, prostat kanseri, glioblastom, kolorektal kanser, akciğer kanseri, post-translasyonel modifikasyon, kanser tedavisi.