Now Reading: Pankreas Kanserinde Yeni Bir Hedef: GOT2’nin Terapötik Potansiyeli
-
01
Pankreas Kanserinde Yeni Bir Hedef: GOT2’nin Terapötik Potansiyeli
Pankreas Kanserinde Yeni Bir Hedef: GOT2’nin Terapötik Potansiyeli
Pankreas kanseri, tıbbi alanda en ölümcül ve tedaviye dirençli kanser türlerinden biri olarak dikkat çekmektedir. Bu tür kanserlerde, hücrelerin sahip olduğu benzersiz metabolik sistemler, hastalığın ilerlemesini ve tedaviye direnç kazanmasını desteklemektedir. Son dönemde yapılan araştırmalar, glutamik-oksaloasetik transaminaz 2 (GOT2) enzimini, pankreas kanseri hücrelerinin hem metabolik hem de bağışıklık sisteminden kaçış süreçlerinde merkezi bir rol oynayan yeni ve umut vaat eden bir hedef olarak ortaya koymuştur.
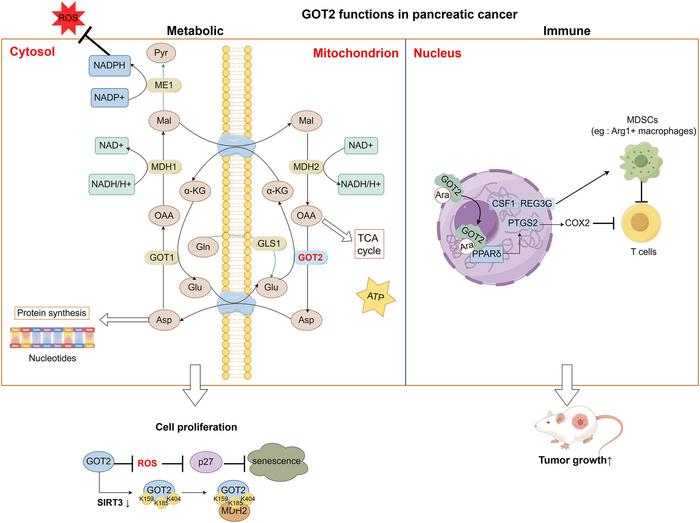
GOT2, mitokondri matriksinde yer alan ve glutamat ile oksaloasetatın transaminasyonunu sağlayan önemli bir enzimdir. Bu işlem, hücre içi NAD+/NADH redoks dengesinin korunmasında kritik bir işlev gören malat-aspartat şantının devamlılığını sağlar. Böylece, görece olarak hızlı enerji ve biyosentez ihtiyaçları olan pankreas kanseri hücrelerinin hem glikoliz hem de mitokondriyal oksidatif fosforilasyon süreçlerinin devamlılığı sağlanır. GOT2 aracılığıyla üretilen özellikle aspartat ve α-ketoglutarat gibi metabolitler, nükleotid biyosentezi ve trikarboksilik asit (TCA) döngüsüne doğrudan besin sağlar.
Diğer birçok kanser tipinden farklı olarak, KRAS onkogen mutasyonu taşıyan pankreas tümörleri, geleneksel glutamin metabolizmasından ayrılarak GOT2’ye bağımlı alternatif bir metabolik program uygulamaktadır. Bu non-kanonik glutamin metabolizması, glutamat dehidrojenaz yolunu bypass ederek, GOT2 aracılığıyla aspartat ve diğer metabolit havuzlarının yenilenmesini sürdürür. Bu durum, hücre döngüsü ve anabolik süreçlerde kritik ara ürünlerin azalmasını engeller. GOT2 inhibisyonu ise, bu temel metabolik akışları kesintiye uğratırken mitokondriyal redoks dengesinin bozulmasına neden olur. Bunun sonucu olarak, reaktif oksijen türleri (ROS) birikir, oksidatif stres artar ve hücre senesansı ya da apoptoz tetiklenir.
GOT2’nin sadece mitokondriyal bir enzim olarak kalmayıp, nükleer ortamda da görev üstlendiği son zamanlarda keşfedilmiştir. Nükleusta, GOT2’nin bir yağ asidi taşıyıcısı olarak işlev görerek peroksizom proliferatör-aktive reseptör delta (PPARδ) adlı transkripsiyon faktörünü aktive ettiği belirlenmiştir. PPARδ, lipid metabolizması, inflamasyon ve bağışıklık modülasyonunda önemli bir rol oynar. Bu aktivasyon, COX-2 (PTGS2), CSF1 ve REG3G gibi immün baskılayıcı genlerin ekspresyonunu artırarak tümör mikroçevresinde T hücresi infiltrasyonunu azaltan ve bağışıklık sistemini baskılayan bir ortam yaratır. GOT2’nin metabolik ve immün regülasyon fonksiyonlarını birleştirmesi, onu pankreas kanserinde hem metabolik hem de bağışıklık kaçışının merkezi bir bileşeni yapmaktadır.
Her ne kadar GOT2 hedeflenerek tedavi umut vaat etse de, pankreas tümörlerinin bu hedefe karşı yüksek adaptif direnç geliştirme kapasitesi bulunmaktadır. Kanser hücreleri, makropinositoz adı verilen büyük çaplı besin alımı yoluyla, dış ortamdan aspartat gibi metabolitleri içeri çekerek GOT2 inhibisyonunun yarattığı metabolik blokajı aşmaktadır. Ayrıca, kanserle ilişkili fibroblastlar (CAF’ler) ile gerçekleşen metabolik etkileşimler de tümör hücrelerine alternatif metabolik kaynaklar sunarak metabolik stres altında bile hücrelerin hayatta kalmasını ve çoğalmasını sağlamaktadır. Bu durum, GOT2 hedefli tedavilerin başarısı için kombinasyon stratejilerinin gerekliliğini ortaya koymaktadır.
GOT2 inhibitörlerinin geliştirilmesi alanında da önemli ilerlemeler yaşanmaktadır. Amino oksiasetat gibi bileşikler, preklinik modellerde etkinlik göstermiştir ve pankreas kanserinin metabolik esnekliğini kırmayı hedefleyen ilk adaylar arasında yer almaktadır. GOT2’ye yönelik bu tür inhibitörlerin, immün kontrol noktası inhibitörleri ve oksidatif stres düzenleyicilerle birlikte kullanılmaları, tümör metabolizması ile immün baskı mekanizmalarını aynı anda hedefleyerek tedavi etkinliğini artırabilecek stratejiler olarak öne çıkmaktadır.
Yapısal biyoloji alanındaki araştırmalar, GOT2 enziminin moleküler mimarisi üzerine kritik bilgiler sunmaktadır. Bu enzim, piridoksal fosfat bağımlı bir aminotransferazdır ve aktif bölge yapısı ile substrat bağlanma dinamikleri, ilaç tasarımında çeşitli müdahale noktaları yaratmaktadır. Koenzim etkileşimleri veya substrat analoğu rekabetçiliği gibi yöntemlerle geliştirilecek spesifik inhibitörler, hedef dışı etkilerin en aza indirilmesi ve klinik başarı şansının artırılması açısından büyük önem taşımaktadır. Yüksek çözünürlüklü kristalografi ve hesaplamalı modellendirme çalışmaları, bu tasarım sürecini hızlandırmaktadır.
Pankreas kanseri hücrelerinin metabolik plastisitesi, onkogenik KRAS sinyalizasyonunun metabolik yeniden programlamadaki etkilerini daha karmaşık hale getirmektedir. KRAS, glukoz ve glutamin metabolizmasını yeniden düzenlemenin yanı sıra, hücre içi redoks ortamını, mitokondriyal fonksiyonları ve lipid sinyal yollarını etkileyerek, tüm bu süreçlerde GOT2’nin kritik roller oynamasını sağlar. Bu çok katmanlı regülasyon mekanizmalarının anlaşılması; direnç oluşumunu önlemek üzere, tekli terapiler yerine çok hedefli stratejilerin geliştirilmesinde kilit rol oynar.
GOT2’nin bağışıklık sisteminden kaçışta oynadığı rol, yeni tedavi yaklaşımlarına kapı aralamaktadır. PTGS2 ve diğer immün baskı genlerinin ekspresyonunu düzenleyerek tümörle ilişkili makrofajları şekillendiren GOT2, sitotoksik T lenfositlerin infiltrasyonunu engeller. Bu eksen üzerinden yapılacak terapötik müdahaleler, bağışıklık kontrol noktası blokaj dirençlerini kırabilir ve tümör mikroçevresindeki immün yanıtı canlandırabilir. Bu bağlamda, GOT2 inhibitörleri, metabolik engellemeyle birlikte bağışıklık sistemini yeniden aktive eden kombinasyon tedavilerinin temel taşlarından biri olma potansiyeline sahiptir.
Preklinik veriler, GOT2 inhibisyonunun kanser hücre proliferasyonunu engellemekle kalmayıp, oksidatif stres yoluyla DNA hasarı ve hücre döngüsü duraksaması oluşturduğunu göstermektedir. Bu zayıflıklar, DNA hasarına yol açan ajanlar veya redoks düzenleyicilerle kombinasyon halinde kullanıldığında tedavi başarısını artırabilir. Terapötik açıdan bu çok boyutlu saldırı, pankreas kanseri tedavisinde GOT2 hedeflemesini cazip kılan bir özelliktir.
Tümör mikroçevresindeki karmaşık dinamikler, GOT2’ye yönelik tedavi stratejilerini zorlaştırmaktadır. Kanser hücreleri, stromal bileşenler, stromal hücreler ve ekstraselüler matriks ile metabolik simbiyoz kurarak direnç mekanizmalarını güçlendirir. Bu ekolojik ağı hedef alan kapsamlı tedavi yöntemleri, GOT2 inhibisyonu ile birlikte solunum ve metabolizma destek hücrelerini hedefleyen ajanların eş zamanlı kullanılmasını gerektirir.
Sonuç olarak, GOT2, pankreas kanser hücrelerinin hem enerji ve anabolik gereksinimlerini karşılayan metabolik programı düzenlemekten sorumludur hem de tümör mikroçevresinin immün baskısında kritik bir rol oynar. Bu çift yönlü işlevi ile, metabolik enzimlerin sadece biyokimyasal katalizörler olarak değil, tümör ve ev sahibi etkileşimlerinin entegre düzenleyicileri olarak da değerlendirilmesi gerektiğini ortaya koyar. Bu anlayış, sıradışı multidisipliner terapötik yaklaşımların geliştirilmesine öncülük etmektedir.
Araştırmalar ilerledikçe, pankreas kanseri tedavisinde GOT2 inhibisyonunun laboratuvar ortamından klinik uygulamalara başarılı şekilde taşınması kilit rol oynayacaktır. Metabolik adaptasyon ve bağışıklık baskısının eş zamanlı olarak hedeflenmesi, uzun süredir tedavisi güç bir malignitede önemli ilerlemelere kapı açabilir. GOT2 araştırmaları, yapısal biyoloji, metabolik biyokimya ve immünoloji alanlarının kesişiminde yer alarak, gelecek nesil kanser terapötiklerinin entegre ve yenilikçi yaklaşımının simgesi olmayı vaat etmektedir.
—
Araştırma Konusu: GOT2 enziminin pankreas kanserindeki fonksiyonları ve terapi hedefi olarak kullanımı
Makale Başlığı: GOT2: New therapeutic target in pancreatic cancer
Web References: http://dx.doi.org/10.1016/j.gendis.2024.101370
Doi Referans: 10.1016/j.gendis.2024.101370
Resim Credits: Genes & Diseases
Anahtar Kelimeler: GOT2, pankreas kanseri, glutamin metabolizması, malat-aspartat şantı, mitokondriyal enzim, redoks dengesi, reaktif oksijen türleri, PPARδ, immünosupresyon, metabolik yeniden programlama, onkogenik KRAS, tümör mikroçevresi