Now Reading: MYC Yolu Hedeflenerek Kanser Tedavisinde Devrim
-
01
MYC Yolu Hedeflenerek Kanser Tedavisinde Devrim
MYC Yolu Hedeflenerek Kanser Tedavisinde Devrim
Kanser Tedavisinde MYC Proteininin Çok Boyutlu Düzenlenmesi ve Hedeflenmesi: Yeni Nesil Terapötik Yaklaşımlar
Kanser biyolojisinin en karmaşık ve merkezi düzenleyicilerinden biri olarak kabul edilen MYC proteini, hücre içi pek çok biyolojik yolakta kritik roller üstlenmektedir. Hem normal hücresel işlevler hem de malign dönüşümlerde anahtar bir aktör olan MYC, geniş kanser türlerinde %70’e yakın oranda düzensizliğe yol açmaktadır. MYC’nin hücre döngüsü ilerlemesini kontrol etmesi, apoptozdan kaçınma yeteneği, anjiyogenezisi teşvik etmesi ve bağışıklık sisteminden kaçınmaya olanak sağlaması, bu onkogenin tümörlerin agresifliğinde ne denli etkili olduğunu ortaya koymaktadır. Günümüzde MYC’yi doğrudan hedef alamama algısı yıkılırken, yeni ilaç geliştirme stratejileri bu zorlu hedefi başarıyla yakalamaktadır.
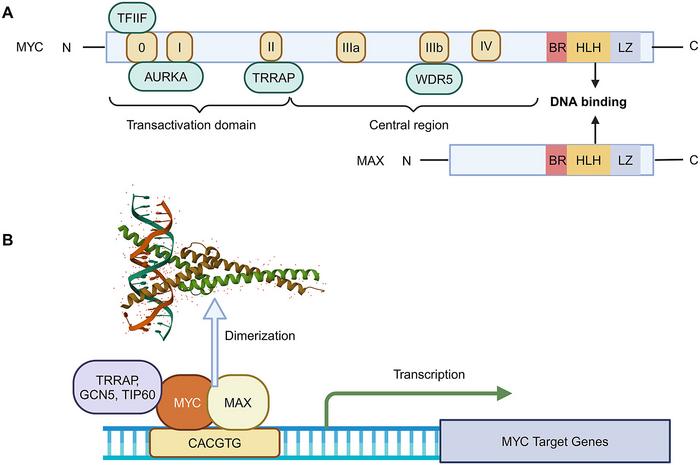
MYC, esas olarak bir transkripsiyon faktörü olarak rol oynar ve hücresel proliferasyon, metabolizma ile hayatta kalma mekanizmalarını düzenler. Onkolojideki öneminin temel nedeni, bu protein üzerindeki kontrolün kaybolmasıyla kanser hücrelerinin hızla çoğalması ve hayatta kalmasıdır. MYC’nin birçok kanser türünde aşırı ekspresyonu veya aktivasyonu, kanser tedavilerinde direnç gelişmesinde önemli rol oynar. Bu nedenle, MYC’ye yönelik terapötik müdahaleler hem tümör büyümesini engellemek hem de mevcut tedavilere duyarlılığı artırmak açısından kritik bir strateji olarak öne çıkmaktadır.
MYC protein yapısındaki intrinsik düzensizlik, ilaç geliştirmede önemli zorluklar yaratmıştır. Klasik küçük molekül ilaçların hedef aldığı belirgin bağlanma ceplerinin olmaması, MYC’nin “tedavi edilemez” olarak damgalanmasına neden olmuştur. Ayrıca MYC’nin çok sayıda proteinle karmaşık etkileşim ağları içinde bulunması, doğrudan inhibisyonu zorlaştırmıştır. Ancak, son yıllarda gelişen yapısal biyoloji ve kimya alanındaki ilerlemeler sayesinde MYC-MAX heterodimerizasyonu gibi esansiyel süreçlerin engellenmesi yeni bir tedavi kapısı aralamıştır.
OMO-103 gibi moleküller, MYC-MAX kompleksinin oluşumunu selektif olarak bozarak MYC’nin transkripsiyonel aktivitesini etkisiz hale getirmektedir. Klinik öncesi ve erken faz klinik çalışmalarda bu bileşiklerin tümör hücrelerindeki proliferasyonu kontrollü şekilde engellediği gösterilmiştir. Böylece, MYC gibi karmaşık ve yapısal olarak düzensiz proteinlerin hedeflenebilir olduğu; keskin yapı-temelli ilaç tasarımı ile mümkün hale gelmiştir.
MYC’ye yönelik terapiler sadece doğrudan inhibitörlerle kısıtlı kalmamaktadır. MYC mRNA’sının sentezinin baskılanması veya translasyonunun engellenmesi gibi dolaylı yöntemler, protein düzeylerinin hücre içinde azaltılmasında önemli avantajlar sunmaktadır. Antisense oligonükleotidler, RNA interferans teknolojileri ve MYC’nin upstream regülatörlerini hedefleyen küçük moleküller bu yaklaşımın öncü unsurlarıdır. Bu yöntemler etkinliği korurken, hedef dışı yan etkilerin azaltılmasına olanak tanımaktadır.
Bunun yanı sıra, PROTAC (Proteolysis Targeting Chimera) teknolojisi, hücrenin doğal protein yıkım sistemini kullanarak MYC proteinini selektif olarak degradasyona uğratmayı sağlayan devrim niteliğinde bir stratejidir. Bu yöntem doğrudan fonksiyon inhibisyonu yerine, tüm MYC protein havuzunun ortadan kaldırılmasını hedefleyerek tedaviye yeni bir boyut kazandırmaktadır. PROTAC teknolojisinin MYC gibi yapısal düzensizliğe sahip proteinlerde kullanılabilirliği, ilaç keşfi alanında önemli bir dönüm noktasıdır.
Sentetik ölüm (synthetic lethality) konsepti ise, MYC aşırı ekspresyonuna bağımlı kanser hücrelerinin hayatta kalabilmek için gereksinim duyduğu kritik yolakların hedeflenmesini sağlar. Normal hücrelerde bu yolaklar esnekken, MYC’ye bağımlı kanser hücrelerinde bu esneklik kalmadığından, bu akıllı yaklaşım kanser hücrelerine özgü yüksek seçicilik sergileyerek saldırır. Böylece tedavi etkinliği artırılırken, sağlıklı hücrelere yönelik yan etkiler minimize edilir.
Günümüzde MYC hedefli ilaçlar, hem küçük molekül inhibitörler hem de protein degradasyon teknolojileriyle kombine edilerek kullanılıyor. Bu kombinasyonlar, tek başına uygulanan tedavilerin karşılaştığı direnç mekanizmalarının üstesinden gelmek ve terapötik etkiyi artırmak amacıyla geliştirilmiştir. Kişiselleştirilmiş tıp ilkeleri doğrultusunda, tümörlerin MYC ekspresyon profili ve moleküler özellikleri temel alınarak tedavi stratejileri optimize edilmektedir.
Ancak MYC’nin sadece tümör hücrelerinde değil, normal dokularda da önemli roller üstlenmesi, bu hedefe yönelik terapötik müdahalelerde dikkat edilmesi gereken bir husustur. MYC’nin doku yenilenmesi ve homeostazda kritik işlevleri olduğu için, geniş kapsamlı inhibisyon yaşlanma belirtileri veya dokularda fonksiyon kaybı gibi istenmeyen sonuçlar doğurabilir. Bu nedenle terapi pencerelerinin hassas şekilde tanımlanması ve MYC aktiviteyi gösteren biyobelirteçlerin kullanılması hayati önem taşımaktadır.
MYC’nin etkileşim ağının daha iyi anlaşılması, onun düzenleyici çevrimlerinde kritik rol oynayan yardımcı proteinler, kromatin remodelörleri ve sinyal ara elemanları üzerinden dolaylı hedefleme fırsatları sunmaktadır. MYC ile ilişkili bu ekosistem bileşenlerinin kombine olarak hedeflenmesi, tedaviye karşı ortaya çıkan kompansatuar direnç mekanizmalarını da önleyerek daha kalıcı klinik yanıtların alınmasını mümkün kılmaktadır.
MYC’nin immün kaçış mekanizmalarındaki rolü, immunoterapinin MYC hedefli tedavilerle entegrasyonunu desteklemektedir. MYC’nin tümör mikroçevresindeki bağışıklık gözetim mekanizmalarını baskılaması, tümörün bağışıklık sisteminden kaçmasına olanak vermektedir. MYC sinyalinin kesilmesi, immün tanımayı yeniden etkinleştirerek, immün kontrol noktası inhibitörleri veya hücresel immünoterapilerle kombine edildiğinde tedavi etkinliğini artırabilir. Bu disiplinlerarası yaklaşım, modern kanser tedavisinde bütüncül bir paradigm olarak önem kazanmaktadır.
Sonuç olarak, MYC’nin kanser biyolojisindeki merkezi yeri ve tedavi hedefi olarak ortaya konması, tıptaki “tedavi edilemez” protein algısını değiştirmiştir. Yapısal biyoloji, kimyasal inovasyon, moleküler genetik ve klinik araştırmaların kesişiminde ortaya çıkan çok boyutlu terapötik yaklaşımlar, MYC hedefli kanser tedavisinde yeni bir dönemin kapılarını aralamıştır. Bu disiplinlerarası ilerleme, temel onkogenik süreçlerin anlaşılmasından klinik uygulamalarla sonuç alınmasına uzanan bilimsel yolculuğun güçlü bir örneğidir.
MYC regülasyonunun incelikleri çözüldükçe ve bu proteinin zayıf noktaları keşfedildikçe, gelecekte daha etkili ve güvenli kanser tedavi stratejileri geliştirilmesi beklenmektedir. Süregelen klinik deneyler ve hızlanan ilaç geliştirme süreçleri, MYC odaklı tedavilerin onkoloji alanında yenilikçi bir çığır açacağını göstermektedir. Bu doğrultuda MYC, modern kanser bakımının şekillenmesinde öncü bir moleküler hedef olmaya devam edecektir.
—
**Araştırma Konusu**:
MYC proteininin kanser biyolojisindeki çok boyutlu düzenlenmesi ve terapötik hedeflenme stratejileri
**Makale Başlığı**:
Targeting MYC: Multidimensional regulation and therapeutic strategies in oncology
**Web References**:
http://dx.doi.org/10.1016/j.gendis.2024.101435
**Doi Referans**:
10.1016/j.gendis.2024.101435
**Resim Credits**:
Genes & Diseases
**Anahtar Kelimeler**:
MYC, onkogen, kanser tedavisi, protein degradasyonu, PROTAC, MYC-MAX kompleksi, sentetik ölüm, küçük molekül inhibitörler, transkripsiyon faktörü, ilaç direnci, kişiselleştirilmiş tıp, immüno-onkoloji