Now Reading: mRNA Aşılarındaki Hücresel Regülatörlerin Keşfi Yenilikçi Terapötik Yaklaşımların Kapılarını Açıyor
-
01
mRNA Aşılarındaki Hücresel Regülatörlerin Keşfi Yenilikçi Terapötik Yaklaşımların Kapılarını Açıyor
mRNA Aşılarındaki Hücresel Regülatörlerin Keşfi Yenilikçi Terapötik Yaklaşımların Kapılarını Açıyor
Bilim dünyasında önemli bir gelişmeye imza atan Dr. Kim V. Narry liderliğindeki araştırma ekibi, RNA Araştırmaları Merkezi’nin bir parçası olarak, mRNA aşılarının ve tedavi yöntemlerinin etkinliğini önemli ölçüde etkileyen kritik bir hücresel mekanizmayı ortaya koydu. Science dergisinde yayımlanan bu çalışma, hücre içindeki mRNA’nın taşınması, işlenmesi ve parçalanması ile ilgili karmaşık süreçlerin daha iyi anlaşılmasına yönelik önemli bir adım olarak öne çıkıyor. Bu bulgular, daha etkili aşılar ve RNA tabanlı tedavilerin geliştirilmesi yönünde devrim niteliğinde değişikliklere zemin hazırlayabilir.
Messenger RNA (mRNA), hücrelerin protein sentezi konusunda nasıl yönlendirileceğine dair temel genetik şablon işlevi görmektedir. COVID-19 için geliştirilen aşılar gibi mRNA aşıları bu mekanizmanın üzerine inşa edilmiştir ve kanser ile genetik bozukluklar da dahil olmak üzere çeşitli hastalıkların tedavisinde büyük bir potansiyele sahiptir. Ancak, yabancı mRNA’nın –örneğin aşılardaki mRNA’nın– hücrelere başarılı bir şekilde girişinin sağlanması, vücudun doğuştan gelen bağışıklık savunma mekanizmaları tarafından engellenmeden mümkün olmamaktadır. Şimdiye kadar, hücresel ortamda mRNA’nın yönetimiyle ilgili spesifik düzenleyici süreçler büyük ölçüde gizemini korumaktaydı ve bu da aşı etkinliğini artırma çabalarını karmaşık hale getirmiştir.
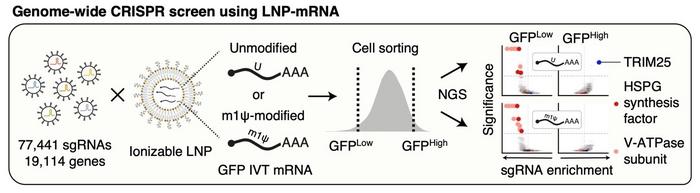
Araştırma ekibi, mRNA teslimatında yer alan hücresel faktörleri ortaya çıkarmak için bir CRISPR tabanlı knockout tarama yöntemi kullanarak bu bilgi açığını ele almayı amaçladı. Bu kapsamlı yaklaşım, 19,114 geni hedefleyen bir CRISPR kütüphanesi kullanılarak, lipid nanopartikülleri (LNP’ler) içinde kapsüllenen mRNA’nın hücresel alımını kolaylaştıran üç ana faktörü belirledi. Bu yenilikçi teknik, karmaşık biyolojik sistemleri çözümlemek için modern genetik araçların ne kadar önemli olduğuna dair önemli bir vurguda bulunmaktadır.
Araştırma ekibinin en dikkat çekici keşiflerinden biri, hücrelerin yüzeyinde bulunan ve heparan sülfat (HSPG) adı verilen sülfatlanmış bir glikoproteinin rolüdür. HSPG’nin, LNP’lerin hücre içine etkili bir şekilde mRNA’nın taşınmasında önemli ölçüde etkili olduğu gösterilmiştir. Bu bulgu, LNP’lerin hücresel zarfla olan etkileşimlerini aydınlatırken, HSPG’nin mRNA aşılarının işleyişinin ilk aşamalarında nasıl kritik bir rol oynadığını ortaya koyuyor.
Bir diğer çarpıcı buluş, endozomal zar içinde bulunan proton pompası olarak işlev gören V-ATPaz üzerinedir. Bu proteinin işlevi, LNP’lerin bulunduğu vezikülleri asitlendirmektir. Bu asitleşme, nanopartikül yüzeyinde pozitif bir yük oluşturur. Bu elektrostatik etkileşim zorunludur çünkü endozomal zarın geçici olarak bozulmasını kolaylaştırarak mRNA’nın sitoplazmaya kaçmasını sağlar ve protein sentezini başlatır. Bu mekanizmanın sonuçları, terapötik ilaçların hücresel giriş yollarının karmaşıklığını vurgulayan önemli çıkarımlara işaret ediyor.
Araştırmanın en çarpıcı bulgularından biri de, yabancı RNA’ya yanıt veren hücresel denetim sisteminin bir parçası olan TRIM25 proteininin rolüdür. TRIM25, dışardan gelen mRNA’ları bağlayarak hızlı bir şekilde parçalar ve biyolojik etkilerinin ortaya çıkmasını engeller. Bu protein, mRNA aşılarının terapötik uygulamalarda başarılı bir şekilde kullanılabilmesi için aşılması gereken kritik bir engel oluşturuyor.
Çalışmanın önemli bir noktası, N1-metilpseudouridin (m1Ψ) ile modifiye edilmiş mRNA’nın, TRIM25 tarafından parçalanmaya karşı gösterdiği direncin keşfidir. Bu moleküler değişiklik, TRIM25’in mRNA’ya bağlanmasını engelleyerek mRNA aşılarının stabilitesini ve etkinliğini artırır. Bu bulgular, mRNA aşılarının hücresel denetimlerden nasıl başarılı bir şekilde kaçabileceğine dair önemli bir mekanizmayı aydınlatmakla kalmayıp, aynı zamanda m1Ψ’nin RNA tabanlı tedavilerin terapötik etkinliğini artırmadaki kritik rolünü de ön plana çıkarıyor.
Araştırma ayrıca, bu çok yönlü süreçte proton iyonlarının kritik rolünü vurguluyor. LNP’ler tarafından endozomal zarın aşılması sonucunda protonlar sitoplazmaya salınır ve iki yönlü bir işlev görür. Bu protonlar, hem mRNA’nın salınması için hücresel koşulları güçlendirir hem de TRIM25’i aktive ederek hücreden gelen savunma yanıtlarını tetikler. Bu bulgular, hücresel mekanizmaların hem yabancı genetik materyallere karşı nasıl korunabileceğini hem de bunların kullanılmasını nasıl kolaylaştırabileceği konusundaki anlayışımı özgün bir şekilde genişletiyor.
Dr. Kim V. Narry, çalışmanın etkilerini ele alırken, mRNA aşılarına karşı bu hücresel yanıtların tam olarak anlaşılmasının gerekliliğine vurgu yaptı. Gelecekteki mRNA terapilerinin, hücresel savunmaları etkin bir şekilde aşabilecek ve endozomal sistemlerden en iyi şekilde yararlanacak stratejiler geliştirmesi potansiyeli üzerine odaklandı. Bu tür çalışmalar, daha güçlü RNA terapilerinin tasarımında önemli ilerlemelere yol açabilir.
Bu araştırmanın bulguları sadece teorik bir anlayışla sınırlı kalmayıp, pratik uygulamalara da uzanmaktadır. 2025 yılının Nisan ayında yayımlanan sonuçlar, aşı formülasyon stratejilerini şekillendirmede kritik bir kavşak noktası olarak dikkat çekiyor ve daha verimli teslimat mekanizmalarının geliştirilmesine olanak tanıyor. Bu çalışma, RNA tabanlı tedavilerin bir sonraki nesli için temel oluştururken, mRNA işleme mekanizmalarının daha fazla incelenmesi gerekliliğini de ortaya koyuyor.
Araştırmada belirgin bir temas noktası, erken müdahalenin önemidir. Vücudun mRNA ile, özellikle aşı bağlamında, nasıl etkileşimde bulunduğunun çözülmesi, daha etkili ve hedeflenmiş tedavi stratejileri geliştirmeye yönelik bilgi sağlar. Bu bilgi, sadece aşılarla ilgili hastalıkları değil, aynı zamanda geniş bir hastalık ve durum yelpazesini ele almak için tedavi tasarımlarının oluşturulmasında kritik bir anahtar rolü üstlenebilir.
Bu çalışma, kanser ve genetik bozukluklar gibi yanlış gen ifadesi ile karakterize hastalıklara yönelik terapiler geliştirmek için yeni yollar açmaktadır. Belirli moleküler değişikliklerin stabiliteyi ve etkinliği artırabileceği anlayışı, yenilikçi tedavi tasarımlarının önünü açmaktadır. Bu içgörüler, biyoteknoloji ve immünoterapinin büyük ilgi gördüğü günümüz ortamında özellikle önem arz etmektedir.
Bu kapsamlı araştırma, bilim camiasına, mRNA teknolojisinin anlaşılması ve uygulanmasına dair değerli bilgiler sunmuştur. Gelişmiş terapilere ve daha güçlü aşı stratejilerine olan artan talep ile birlikte, bu bilgilerin entegrasyonu sağlık hizmeti yaklaşımlarını hızla dönüştürebilecek ve özellikle yeni ortaya çıkan bulaşıcı hastalıklara karşı küresel sağlık üzerinde önemli sonuçlar doğurabilecektir. Dr. Kim ve ekibi tarafından yürütülen titiz çalışmalar, keskin bilim ve hücresel sistemlerin karmaşık dinamiklerinin birleşimini simgelemektedir. Bu araştırma, gelecekte mRNA aşılarının ve terapilerinin, hücresel savunmalarla sadece yan yana olmayıp, aynı zamanda bunlardan nasıl faydalanabileceğini de gösterebilir.
Araştırma Konusu: Hücreler
Makale Başlığı: Exogenous RNA surveillance by proton-sensing TRIM25
Haberin Yayın Tarihi: 4 Nisan 2025
Web References: Yok
Doi Referans: Yok
Resim Credits: Institute for Basic Science
Anahtar Kelimeler: mRNA aşıları, RNA işleme, TRIM25, hücresel savunma mekanizmaları, Heparan sülfat, V-ATPaz, N1-metilpseudouridin, kanser tedavileri, hücresel parçalanma, COVID-19 aşıları, proton iyonları, deneysel çalışma.