Now Reading: mRNA Aşılarındaki Hücresel Regülatör: Yenilikçi Tedavi Yaklaşımlarına Açılan Kapı
-
01
mRNA Aşılarındaki Hücresel Regülatör: Yenilikçi Tedavi Yaklaşımlarına Açılan Kapı
mRNA Aşılarındaki Hücresel Regülatör: Yenilikçi Tedavi Yaklaşımlarına Açılan Kapı
Ünlü bir araştırmacı olan Dr. Kim V. Narry liderliğindeki bir ekip, Science dergisinde yayımladıkları çığır açıcı bir çalışmada, mRNA aşıları ve tedavi müdahalelerinin etkinliğini önemli ölçüde etkileyen kritik bir hücresel mekanizmayı ortaya çıkardı. Bu araştırma, hücreler içinde mRNA’nın teslimi, işlenmesi ve yıkımıyla ilgili karmaşık süreçlerin anlaşılmasında önemli bir adım olarak değerlendiriliyor ve daha etkili aşılar ile RNA tabanlı tedavilerin geliştirilmesinde devrim yaratma potansiyeline sahip.
Messenjer RNA (mRNA), hücrelere protein sentezlemeleri için talimat veren temel genetik şablondur. Bu mekanizma, COVID-19 için geliştirilen aşılar gibi mRNA aşılarının çekirdeğini oluşturur ve kanser ile genetik hastalıklar dahil olmak üzere çeşitli hastalıkların tedavisinde büyük bir potansiyele sahiptir. Ancak, dış mRNA’nın, özellikle aşılarda bulunan mRNA’nın, hücrelere başarılı bir şekilde girmesini sağlamak, vücudun doğal bağışıklık savunma mekanizmaları tarafından engellenmesini aşmak için bir zorluk teşkil etmiştir. Şimdiye kadar, hücresel ortamda mRNA’nın düzenleyici süreçlerine dair spesifik bilgiler büyük ölçüde bilinmezdi ve bu durum aşı etkinliğini artırma çabalarını karmaşıklaştırıyordu.
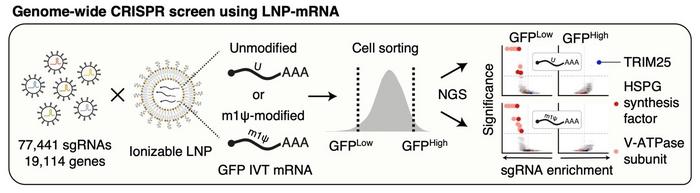
Bu bilgi eksikliğini gidermek amacıyla araştırma ekibi, mRNA teslimine dahil olan hücresel faktörleri ortaya çıkarmak için CRISPR tabanlı bir knockout tarama yöntemi kullandı. Bu kapsamlı yaklaşım, 19,114 geni hedefleyen bir CRISPR kütüphanesi kullanarak, lipid nanoparçacıkları (LNP) içinde kapsüllenen mRNA’nın hücre tarafından alınmasında önemli üç ana faktörü tespit etti. Bu yenilikçi teknik, karmaşık biyolojik sistemleri incelemek için modern genetik araçların önemini vurguluyor.
Araştırma ekibinin yaptığı en dikkate değer keşiflerden biri, hücre yüzeyinde bulunan ve heparan sülfat (HSPG) olarak bilinen sülfatlı glikoproteinin rolüdür. HSPG, lipid nanoparçacıklarının çekimini önemli ölçüde etkileme yeteneğine sahiptir ve bu nanoparçacıklar, mRNA’nın hücrelerin sitoplazmik iç kısmına etkili bir şekilde iletimi için kritik öneme sahiptir. Bu bulgu, LNP’ler ile hücresel zarlı etkileşimlerin anlaşılmasına yeni bir ışık tutar ve HSPG’nin mRNA aşılarında işlevselliğin erken aşamalarındaki vazgeçilmez rolünü vurgular.
Bir diğer çığır açıcı buluş ise, endozomal zarda bulunan bir proton pompası olan V-ATPase üzerinedir. Bu proteinin işlevi, LNP’leri içeren veziküllerin asidik olmasını sağlamak ve ardından nanoparçacığın yüzeyinde pozitif bir yük oluşturulmasıdır. Bu elektrostatik etkileşim son derece önemlidir çünkü endozom zarfının geçici olarak bozulmasını sağlıyor ve yük mRNA’nın sitoplazmaya kaçmasını ve protein sentezini başlatmasını sağlıyor. Bu mekanizmanın etkileri çok geniş kapsamlıdır ve terapötik ilaçların hücresel giriş yollarındaki karmaşıklığı vurgular.
Bu araştırmadan belki de en çarpıcı buluş, TRIM25 adlı bir proteinin rolüdür. Bu protein, yabancı RNA’ya yanıt veren hücresel gözetim sisteminin bir parçasıdır. TRIM25, dış mRNA’ları bağlayarak hızlı bir şekilde yıkar ve potansiyel biyolojik etkilerini etkisiz hale getirir. Bu proteinin varlığı, mRNA aşılarının terapötik uygulamalarda başarılı bir şekilde kullanılabilmesi için aşması gereken kritik bir engel teşkil etmektedir.
Çalışmanın önemli bir noktası, N1-metilpseudouridin (m1Ψ) ile modifiye edilmiş mRNA’nın, TRIM25 aracılı yıkıma karşı direnç gösterdiğinin keşfidir. Bu moleküler değişiklik, TRIM25’in mRNA’ya bağlanmasını engelleyerek mRNA aşılarının stabilitesini ve genel etkinliğini artırır. Bu gibi bulgular, mRNA aşılarının hücresel gözetimin nasıl başarılı bir şekilde aşılabileceğini aydınlatmakla kalmayıp, aynı zamanda m1Ψ’nin RNA tabanlı tedavilerin terapötik etkinliğini artırmadaki hayati rolünü de vurgular.
Ayrıca, araştırma, bu çok yönlü süreçte proton iyonlarının kritik rolüne dikkat çekmektedir. LNP’ler endozomal diyaframı aşmayı başardığında, protonu cytoplazmaya salmaktadır. Bu durum, yalnızca mRNA serbest bırakılması için hücresel koşulları iyileştirmekle kalmaz, aynı zamanda TRIM25’i aktive ederek hücrenin savunma yanıtını tetikler. Bu bulgular, hücresel mekanizmaların nihayetinde hem yabancı genetik materyali koruyabileceğini hem de bu materyali kullanma süreçlerini kolaylaştırabileceğini anlayabilmemiz açısından devrim niteliğindedir.
Dr. Kim V. Narry, araştırmanın sonuçlarını değerlendirirken, mRNA aşılarına yönelik bu hücresel yanıtların tam olarak anlaşılmasının gerekliliğine vurgu yaptı. Gelecek mRNA tedavilerinin, hücresel savunmaları aşabilen ve endozomal sistemlerden faydalanarak etkinliği artıran stratejiler geliştirmesi potansiyelinden bahsetti. Bu çalışmalar, daha güçlü RNA terapileri tasarlama konusunda önemli gelişmelere yol açabilir.
Bu araştırmanın sonuçları, yalnızca teorik bir anlayışla sınırlı kalmayıp, pratik uygulamalara da uzanıyor. 2025 yılının Nisan ayında yayımlanan bu bulgular, gelecekteki aşı formülasyon stratejilerini şekillendirebilecek kritik bir anı temsil ediyor ve daha verimli teslim mekanizmalarının geliştirilmesine olanak tanıyor. Bu çalışma, bir sonraki nesil RNA tabanlı terapilerin temelini atıyor ve RNA işleme süreçlerini yöneten hücresel mekanizmaların derinlemesine araştırılmasının acil bir ihtiyaç olduğunu vurguluyor.
Araştırmanın temel temalarından biri erken müdahalenin önemidir. Vücudun mRNA ile etkileşimi ve özellikle aşı bağlamında nasıl gerçekleştiğini çözümleyerek, araştırmacılar daha etkili ve doğru hedeflenmiş gelecek nesil tedavilerin geliştirilmesine yardımcı olabilir. Bu bilgi, yalnızca aşılarla ilgili hastalıkları değil, aynı zamanda geniş bir hastalık yelpazesine hitap eden tedavi tasarımlarında da anahtar bir rol oynamaktadır.
Bu bulgular, bozuk gen ifadesi ile karakterize edilen hastalıklar için terapiler geliştirme konusundaki yeni yolları da açmaktadır. Stabilite ve etkinliği artırabileceği belirlenen belirli moleküler değişikliklerin anlaşılması, yenilikçi terapötik tasarımlar için yeni yaklaşımların kapılarını aralamaktadır. Bu bilgiler, biyoteknoloji ve immünoterapinin büyük bir ilgi gördüğü günümüz ortamında özellikle önemlidir.
Dr. Kim ve ekibinin titiz araştırmaları, bilim camiasına, mRNA teknolojisinin anlaşılmasını ve uygulanmasını yükseltme vaadi taşıyan paha biçilmez bilgiler sunmaktadır. Gelişmiş terapilere ve daha sağlam aşı stratejilerine olan artan talep ile bu bilginin entegrasyonu, özellikle yeni enfeksiyon hastalıkları ile yüzleşirken sağlık hizmeti yaklaşımlarını dönüştürebilecek büyük sonuçlar yaratabilir.
Dr. Kim ve ekibi tarafından gerçekleştirilen bu titiz araştırma, günümüzdeki sağlık zorluklarına yanıt arayan, keskin bilim ile karmaşık hücresel sistemlerin dinamiklerinin kesişimini gösteren bir örnek teşkil etmektedir. mRNA aşıları ve terapilerinin hücresel savunmalarla var olmaktan çok, bunların üstesinden gelerek başarılı olacağı bir geleceği temsil etmektedir. Bu durum, toplumun karşılaştığı karmaşık sağlık sorunları için yenilikçi çözümler sunma potansiyeli taşımaktadır.
Araştırma Konusu: Hücreler
Makale Başlığı: Yabancı RNA gözetimi tarafından proton algılayan TRIM25
Haberin Yayınlanma Tarihi: 4 Nisan 2025
Web Referansı: Bulunmamaktadır
Makale Referansı: Bulunmamaktadır
Resim Credits: Institute for Basic Science
Anahtar Kelimeler: mRNA aşıları, RNA işleme, TRIM25, hücresel savunma mekanizmaları, Heparan sülfat, V-ATPase, N1-metilpseudouridin, kanser tedavileri, hücresel yıkım, COVID-19 aşıları, proton iyonları, deneysel çalışma.