Now Reading: Kanser Progresyonunda Yağ Asidi Metabolizmasının Merkezi Rolü ve Terapötik Hedeflenmesi
-
01
Kanser Progresyonunda Yağ Asidi Metabolizmasının Merkezi Rolü ve Terapötik Hedeflenmesi
Kanser Progresyonunda Yağ Asidi Metabolizmasının Merkezi Rolü ve Terapötik Hedeflenmesi
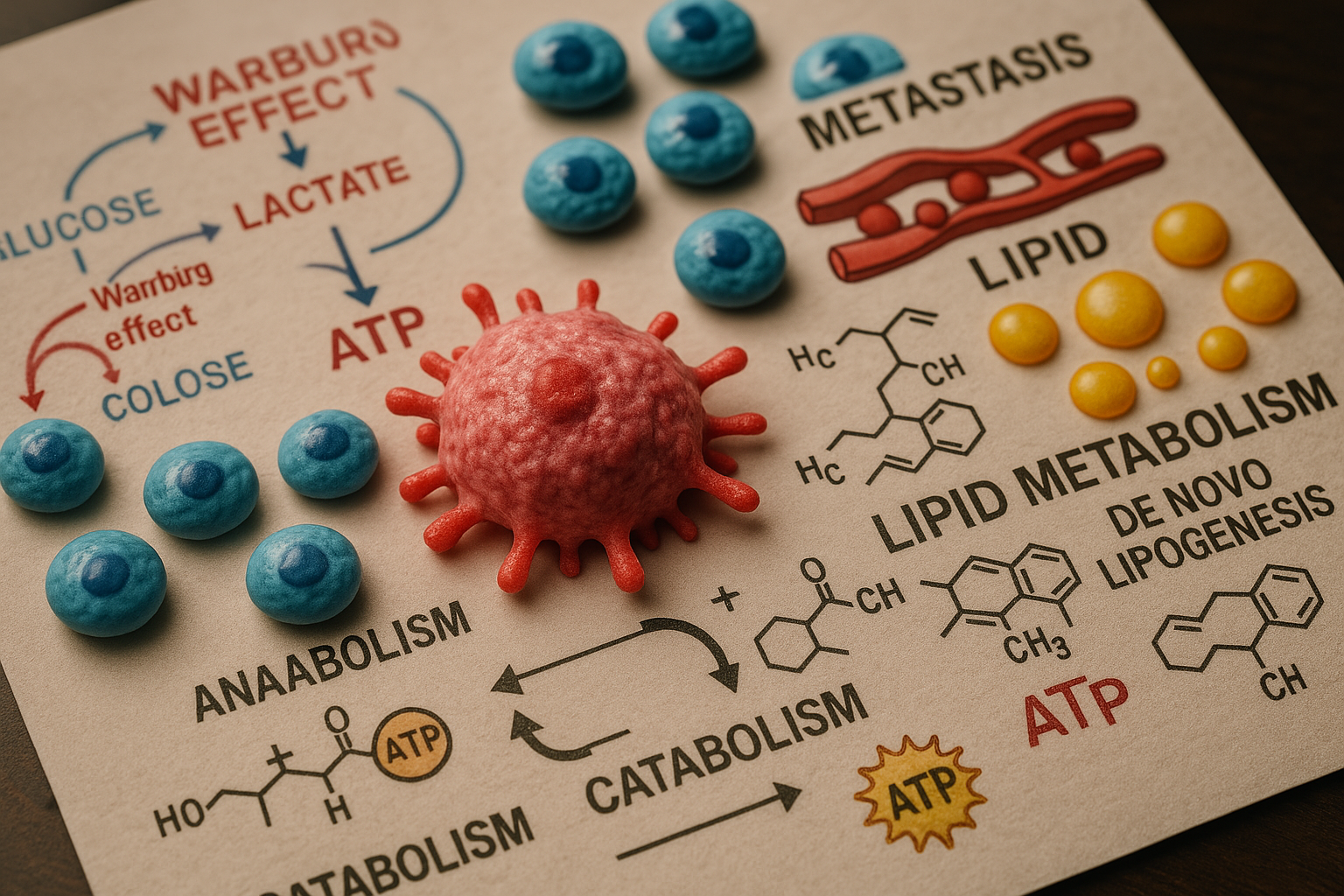
Hücrelerin kanserleşme sürecine girmesiyle birlikte, kontrolsüz proliferasyon ve metastaz gibi malign fenotipleri desteklemek üzere hücresel metabolizmaları temelden yeniden düzenlenir. Bu metabolik yeniden programlama, kanserin temel ayırt edici özelliklerinden biri olarak kabul görmekte ve hücrelerin hem anabolik (yapım) hem de katabolik (yıkım) süreçlerini, artan biyosentetik ve enerjetik taleplerini karşılayacak şekilde optimize etmelerini içerir [1]. Normal, farklılaşmış hücreler genellikle belirli metabolik yolları tercih ederken, kanser hücreleri sıklıkla glikoliz (Warburg etkisi olarak da bilinir) ve lipit metabolizması gibi çeşitli yolları eş zamanlı olarak veya değişen koşullara adapte olacak şekilde esnek bir biçimde kullanır [2]. Bu metabolik adaptasyonlar, sadece hızla bölünen hücreler için gerekli yapı taşlarını (nükleotitler, amino asitler, lipitler) ve enerjiyi (ATP) sağlamakla kalmaz, aynı zamanda hücresel redoks dengesini (NADPH üretimi gibi) koruyarak ve onkojenik sinyal yollarını destekleyerek tümörün hayatta kalmasına ve büyümesine katkıda bulunur.
Özellikle lipit metabolizması, kanser biyolojisinde merkezi bir rol oynamaktadır ve bu alandaki yeniden programlama oldukça belirgindir. Malign transformasyon geçiren hücreler, lipit gereksinimlerini karşılamak için çift yönlü bir strateji izlerler: Bir yandan çevrelerinden, yani tümör mikroçevresinden veya dolaşımdan, ekzojen yağ asitlerinin (FA) alımını artırırlar; diğer yandan ise glukoz ve glutamin gibi lipit olmayan öncüllerden başlayarak kendi yağ asitlerini ve kolesterollerini sentezledikleri de novo lipogenez (DNL) yolunu aktive ederler [3, 4]. Bu iki kaynağı (ekzojen alım ve endojen sentez) aynı anda kullanabilme yeteneği, kanser hücrelerine tümör mikroçevresindeki besin dalgalanmalarına karşı önemli bir metabolik esneklik ve dayanıklılık kazandırır, böylece sürekli lipit teminini güvence altına alırlar.
Lipitlerin kanser hücresindeki fonksiyonları, sadece enerji depolama molekülleri (trigliseritler) veya hücre zarlarının temel yapı taşları (fosfolipidler, kolesterol) olmalarının ötesine geçer. Lipitler ve onların metabolitleri, aynı zamanda hücre içi ve hücreler arası sinyal iletiminde kritik roller üstlenen biyoaktif moleküllerdir. Örneğin, fosfolipidlerden türeyen diasilgliserol (DAG) protein kinaz C’yi (PKC) aktive edebilirken, fosfatidilinositol trifosfat (PIP3) PI3K/Akt gibi hayatta kalma ve büyüme yollarında anahtar bir aracıdır. Ayrıca, çoklu doymamış yağ asitlerinden (PUFA) türetilen eikozanoidler (prostaglandinler, lökotrienler gibi) inflamasyon, anjiyogenez ve hücre proliferasyonu gibi süreçleri modüle edebilir [5]. Bu nedenle, lipit metabolizmasının yeniden düzenlenmesi, onkojenik sinyal ağlarının aktivasyonunu ve sürdürülmesini de doğrudan etkileyerek kanser progresyonunu teşvik eder.
Ekzojen yağ asitlerinin hücre içine verimli bir şekilde alınması, hücre zarında bulunan spesifik taşıyıcı proteinlerin aktivitesine bağlıdır. Kanser hücreleri, bu taşıyıcıların ekspresyonunu sıklıkla artırarak lipit alım kapasitelerini yükseltirler. Bu taşıyıcılar arasında, özellikle uzun zincirli yağ asitlerinin ve modifiye lipoproteinlerin alınmasında görev alan CD36 (FAT – Fatty Acid Translocase olarak da bilinir), hücre içinde yağ asitlerinin taşınmasını ve hedeflenmesini sağlayan çeşitli yağ asidi bağlayıcı proteinler (FABP’ler) ve kolesterol açısından zengin düşük yoğunluklu lipoprotein (LDL) partiküllerini hücre içine alan LDL reseptörü (LDLR) ailesi üyeleri öne çıkar [6, 7]. Bu taşıyıcıların artan aktivitesi, kanser hücrelerinin TME’deki lipit açısından zengin ortamdan veya dolaşımdaki lipoproteinlerden maksimum düzeyde faydalanmasını sağlar.
Hücre dışı ortamdan alınabilecek yağ asitlerinin profili, büyük ölçüde bireyin diyetetik alışkanlıkları tarafından şekillendirilir. Bu durum, diyetin kanser riskini ve progresyonunu etkileyebileceği potansiyel mekanizmalardan birini oluşturur. Özellikle, palmitik asit gibi doymuş yağ asitleri (SFA) açısından zengin diyetlerin (genellikle hayvansal yağlarda, işlenmiş gıdalarda ve bazı tropikal yağlarda bulunur) tüketimi, bazı deneysel modellerde ve epidemiyolojik çalışmalarda artan kanser riski veya daha agresif tümör davranışları ile ilişkilendirilmiştir. SFA’ların potansiyel pro-tümörijenik etkileri, hücre zarı akışkanlığını değiştirerek reseptör fonksiyonlarını etkilemeleri, inflamatuar yolları tetiklemeleri veya doğrudan belirli sinyal yollarını aktive etmeleri gibi mekanizmalar üzerinden gerçekleşebilir. Dikkat çekici bir şekilde, metastazı başlatan hücrelerin özellikle CD36 aracılığıyla palmitat gibi SFA’ları tercih ettiği ve bu alımın metastatik potansiyeli artırdığı gösterilmiştir [6].
Tekli doymamış yağ asitleri (MUFA’lar), örneğin zeytinyağında bol miktarda bulunan oleik asit, ve çoklu doymamış yağ asitleri (PUFA’lar) söz konusu olduğunda durum daha karmaşıktır ve etkileri hem yağ asidinin türüne (örn. Omega-3 vs Omega-6) hem de hücresel bağlama göre değişkenlik gösterebilir [8]. Omega-6 PUFA’lar (mısır, ayçiçek, soya gibi birçok bitkisel yağda yaygındır), özellikle araşidonik asit, siklooksijenaz (COX) ve lipoksijenaz (LOX) enzimleri tarafından pro-inflamatuar ve potansiyel olarak pro-tümörijenik eikozanoidlere (örn. Prostaglandin E2) dönüştürülür. Diyette yüksek Omega-6/Omega-3 oranı, bu pro-inflamatuar yolakları baskın hale getirebilir [9]. Buna karşılık, yağlı balıklar, keten tohumu ve ceviz gibi kaynaklarda bulunan Omega-3 PUFA’lar (EPA ve DHA gibi), aynı enzimleri kullanarak daha az inflamatuar veya hatta anti-inflamatuar ve pro-rezolüsyon mediyatörleri (rezolvinler, protektinler gibi) üretirler. Bu nedenle, Omega-3 PUFA’larının alımının artırılmasının bazı kanser türlerinde koruyucu olabileceği veya tedaviye yanıtı iyileştirebileceği düşünülmektedir [10, 11].
Ekzojen lipit kaynaklarına ek olarak, kanser hücrelerinin çoğu endojen lipit sentez kapasitelerini, yani de novo lipogenezi (DNL) önemli ölçüde artırır. Bu anabolik yol, mitokondriden sitoplazmaya ihraç edilen sitratın (genellikle glukoz veya glutamin metabolizmasından türetilir) ATP-sitrat liyaz (ACLY) enzimi tarafından asetil-CoA’ya dönüştürülmesiyle başlar. Ardından, asetil-CoA karboksilaz (ACC) asetil-CoA’yı malonil-CoA’ya karboksile eder ve son olarak, çok fonksiyonlu bir enzim kompleksi olan yağ asidi sentaz (FASN), asetil-CoA ve malonil-CoA moleküllerini kullanarak uzun zincirli doymuş yağ asidi olan palmitatı sentezler [12]. Bu DNL yolundaki anahtar enzimlerin (ACLY, ACC, FASN) ekspresyonu ve aktivitesi, genellikle PI3K/Akt veya MAPK gibi onkojenik sinyal yolları tarafından yukarı regüle edilir ve birçok kanser türünde artmış olarak bulunur.
Bu DNL enzimlerinin yüksek seviyeleri, sıklıkla tümörün agresifliği, tedaviye direnç ve hastanın kötü prognozu ile ilişkilendirilmiştir [3, 13]. Diyet, DNL aktivitesini dolaylı olarak etkileyebilir. Özellikle yüksek glisemik indeksli karbonhidratlar açısından zengin diyetler, kan şekeri ve insülin seviyelerinde hızlı artışlara neden olur. İnsülin ve ilişkili büyüme faktörleri (örneğin IGF-1), hem glukozun hücre içine alımını artırır (DNL için substrat sağlar) hem de SREBP-1c gibi lipojenik transkripsiyon faktörlerini aktive ederek ACLY, ACC ve FASN gibi DNL enzimlerinin gen ekspresyonunu doğrudan uyarır [14 – ilişki bağlamında]. Bu durum, Batı tarzı diyetlerin bazı kanser türlerinin gelişimine veya ilerlemesine nasıl katkıda bulunabileceğine dair bir mekanizma sunmaktadır.
Hücreler tarafından elde edilen veya sentezlenen yağ asitleri, enerji ihtiyacını karşılamak üzere mitokondride β-oksidasyon adı verilen bir süreçle yıkılabilir. Bu katabolik yol, yağ asidi zincirlerini ardışık olarak iki karbonlu asetil-CoA birimlerine parçalar. Üretilen asetil-CoA, trikarboksilik asit (TCA) döngüsüne girerek oksidatif fosforilasyon yoluyla büyük miktarda ATP üretilmesini sağlar [15]. β-oksidasyon ayrıca, kanser hücrelerinde sıklıkla artan oksidatif stresle başa çıkmak için kritik öneme sahip olan NADPH’ın (TCA döngüsü ara ürünleri veya ilişkili anaplerotik reaksiyonlar yoluyla) üretimine de katkıda bulunur. Özellikle tümör içindeki hipoksik (oksijensiz) veya besin açısından fakir bölgelerde, glikolizin sınırlı olduğu durumlarda, β-oksidasyon kanser hücreleri için alternatif ve hayati bir enerji kaynağı haline gelir, böylece metabolik esnekliklerini ve zorlu koşullar altında hayatta kalma yeteneklerini artırır [16].
Tümör mikroçevresi (TME), kanser hücresi metabolizmasını etkileyen karmaşık bir hücresel ve moleküler ağdır ve lipit metabolizması bu etkileşimde önemli bir rol oynar. Özellikle obezite durumunda, hipertrofik ve hiperplastik adipoz doku (yağ dokusu), sadece aşırı miktarda serbest yağ asidi salgılamakla kalmaz, aynı zamanda çeşitli adipokinler (örn. proliferasyonu teşvik eden leptin ve genellikle anti-proliferatif olan ancak obezitede seviyeleri düşebilen adiponektin), büyüme faktörleri (HGF, VEGF gibi) ve pro-inflamatuar sitokinleri (TNF-α, IL-6 gibi) de TME’ye salar [17]. Bu moleküllerin kokteyli, komşu kanser hücrelerinin proliferasyonunu, invazyonunu, anjiyogenezi ve lipit metabolizmasını (hem alım hem de DNL) doğrudan uyararak, obezitenin birçok kanser türü için neden önemli bir risk faktörü olduğunu ve agresif tümör davranışlarını nasıl desteklediğini açıklamaya yardımcı olur [18]. Adipositler ve kanser hücreleri arasındaki bu yoğun metabolik ve sinyal alışverişi, tümör progresyonunu hızlandıran kısır bir döngü yaratabilir.
Kanser hücrelerinin dikkate değer özelliklerinden biri de metabolik plastisiteleridir; yani değişen koşullara veya terapötik baskılara yanıt olarak metabolik yollarını dinamik olarak yeniden yapılandırabilme yetenekleridir. Örneğin, DNL’nin veya yağ asidi desatürasyonunun (doymuş yağ asitlerini doymamış yağ asitlerine dönüştüren süreç, örn. SCD-1 enzimi ile) farmakolojik inhibitörlerle hedeflenmesi durumunda, hücreler sıklıkla bu baskıdan kaçmak için mekanizmalar geliştirebilirler. Bu kaçış mekanizmaları arasında, inhibe edilen enzimin işlevini telafi edebilecek alternatif izoenzimlerin (örn. SCD-1 inhibisyonuna yanıt olarak FADS2 desatürazının) yukarı regülasyonu veya ekzojen lipit alım yollarının (örn. CD36 ekspresyonunun artırılması) daha da aktive edilmesi sayılabilir [19]. Bu adaptif yanıtlar, lipit metabolizmasını hedefleyen tedavilere karşı direnç gelişiminin altında yatan temel nedenlerden biridir ve terapötik stratejilerin tasarlanmasında dikkate alınması gereken önemli bir zorluktur.
Lipit metabolizmasının kanser biyolojisindeki bu çok yönlü ve kritik rolü, onu cazip bir terapötik hedef haline getirmiştir. Nitekim, DNL yolundaki anahtar enzimleri (örn. ACLY inhibitörü SB-204990, FASN inhibitörü TVB-2640) veya yağ asidi alımını (örn. CD36 inhibitörü Nobiletin) hedefleyen çeşitli küçük moleküllü inhibitörler geliştirilmiş ve preklinik modellerde umut verici anti-tümör etkinlik göstermiştir; bazıları erken faz klinik denemelere ilerlemiştir [6, 20]. Ancak, kanser hücrelerinin yukarıda bahsedilen metabolik plastisitesi ve kaçış mekanizmaları göz önüne alındığında, tek bir enzimi veya yolu hedeflemenin uzun vadeli etkinliği sınırlı olabilir. Bu nedenle, lipit metabolizmasındaki birden fazla kritik noktayı aynı anda hedefleyen (örn. hem DNL hem de β-oksidasyonu inhibe eden) veya lipit metabolizması inhibitörlerini standart kemoterapilerle, hedefe yönelik diğer tedavilerle ya da potansiyel olarak belirli diyet müdahaleleriyle (örn. ketojenik diyetler veya spesifik yağ asidi kısıtlamaları) birleştiren kombinasyonel yaklaşımların daha başarılı olma potansiyeli bulunmaktadır. Bununla birlikte, bu tür stratejilerin etkinliği ve güvenliği büyük ölçüde kanser türüne, hastanın bireysel metabolik profiline ve genetik yapısına bağlı olacağından, tedaviye yanıtı öngörebilecek biyobelirteçlerin tanımlanması ve yaklaşımların kişiselleştirilmesi büyük önem taşımaktadır [21].
Referanslar
- Hanahan, D., & Weinberg, R. A. (2011). Hallmarks of cancer: the next generation. Cell, 144(5), 646–674. https://doi.org/10.1016/j.cell.2011.02.013
- Pavlova, N. N., & Thompson, C. B. (2016). The emerging hallmarks of cancer metabolism. Cell Metabolism, 23(1), 27–47. https://doi.org/10.1016/j.cmet.2015.12.006
- Menendez, J. A., & Lupu, R. (2007). Fatty acid synthase and the lipogenic phenotype in cancer pathogenesis. Nature Reviews Cancer, 7(10), 763–777. https://doi.org/10.1038/nrc2227
- Currie, E., Schulze, A., Zechner, R., Walther, T. C., & Farese Jr, R. V. (2013). Cellular fatty acid metabolism and cancer. Cell Metabolism, 18(2), 153–161. https://doi.org/10.1016/j.cmet.2013.05.017
- Beloribi-Djefaflia, S., Vasseur, S., & Guillaumond, F. (2016). Lipid metabolic reprogramming in cancer cells. Oncogenesis, 5(1), e189. https://doi.org/10.1038/oncsis.2015.49
- Pascual, G., Avgustinova, A., Mejetta, S., Martín, M., Castellanos, A., Attolini, C. S. O., Berenguer, A., Prats, N., Toll, A., Hueto, J. A., Bescós, C., Di Croce, L., & Benitah, S. A. (2017). Targeting metastasis-initiating cells through the fatty acid receptor CD36. Nature, 541(7635), 41–45. https://doi.org/10.1038/nature20791
- Glatz, J. F., & Luiken, J. J. (2017). From membrane transporters to central regulators of fatty acid metabolism. Current Opinion in Lipidology, 28(3), 237–243. https://doi.org/10.1097/MOL.0000000000000411
- Martin-Pardillos, A., Fernández-Marcos, P. J., & Herranz, D. (2021). The multifaceted roles of unsaturated fatty acids in cancer. Cancers, 13(16), 4039. https://doi.org/10.3390/cancers13164039
- Fabian, C. J., Kimler, B. F., & Hursting, S. D. (2015). Omega-3 fatty acids for breast cancer prevention and survivorship. Breast Cancer Research, 17(1), 62. https://doi.org/10.1186/s13058-015-0571-6
- Vaughan, V. C., Hassing, M. R., & Lewandowski, P. A. (2013). Marine polyunsaturated fatty acids and cancer therapy. British Journal of Cancer, 108(3), 486–492. https://doi.org/10.1038/bjc.2012.586
- Azrad, M., Turgeon, C., & Demark-Wahnefried, W. (2013). Current evidence linking polyunsaturated fatty acids with cancer risk and progression. Frontiers in Oncology, 3, 224. https://doi.org/10.3389/fonc.2013.00224
- Rohrig, F., & Schulze, A. (2016). The multifaceted roles of fatty acid synthesis in cancer. Nature Reviews Cancer, 16(11), 732–749. https://doi.org/10.1038/nrc.2016.89
- Kuhajda, F. P. (2000). Fatty-acid synthase and human cancer: new perspectives on its role in tumor biology. Nutrition, 16(3), 202–208. https://doi.org/10.1016/s0899-9007(99)00266-x
- Ecker, J., Liebisch, G., Scherer, M., Schmitz, G., & Schölmerich, J. (2010). Differential effects of fatty acids on لا in lipidomic analysis (Not: Bu referansın orijinal metindeki bağlamı diyet karbonhidratlarının lipogenezi dolaylı etkilemesiydi, doğrudan etkisi üzerine olmayabilir. Daha uygun bir kaynak bulunabilir.). Journal of Lipid Research, 51(1), 116–125. https://doi.org/10.1194/jlr.M001917 (Not: Bu referansın spesifik içeriği kontrol edilmeli ve gerekirse daha uygun bir referans ile değiştirilmelidir.)
- Carracedo, A., Cantley, L. C., & Pandolfi, P. P. (2013). Cancer metabolism: fatty acid oxidation in the limelight. Nature Reviews Cancer, 13(4), 227–232. https://doi.org/10.1038/nrc3483
- Schlaepfer, I. R., Rider, L., Rodrigues, L. U., Gijón, M. A., Pac, C. T., Romero, L., Cimic, A., Sirintrapun, S. J., Glodé, L. M., Eckel, R. H., & Cramer, S. D. (2014). Lipid catabolism via CPT1 as a therapeutic target for prostate cancer. Molecular Cancer Therapeutics, 13(10), 2361–2371. https://doi.org/10.1158/1535-7163.MCT-14-0161
- Nieman, K. M., Kenny, H. A., Penicka, C. V., Ladanyi, A., Buell-Gutbrod, R., Zillhardt, M. R., Romero, I. L., Carey, M. S., Mills, G. B., Hotamisligil, G. S., Yamada, S. D., Peter, M. E., Gwin, K., & Lengyel, E. (2011). Adipocytes promote ovarian cancer metastasis and provide energy for rapid tumor growth. Nature Medicine, 17(11), 1498–1503. https://doi.org/10.1038/nm.2492
- Iyengar, N. M., Gucalp, A., Dannenberg, A. J., & Hudis, C. A. (2016). Obesity and cancer mechanisms: Tumor microenvironment and inflammation. Journal of Clinical Oncology, 34(35), 4270–4276. https://doi.org/10.1200/JCO.2016.67.4283
- Peck, B., & Schulze, A. (2016). Lipid desaturation – the next step in understanding fatty acid metabolism in cancer. FEBS Journal, 283(15), 2767–2778. https://doi.org/10.1111/febs.13689
- Zadra, G., Photopoulos, C., & Loda, M. (2013). The fat side of prostate cancer. Biochimica et Biophysica Acta (BBA) – Molecular and Cell Biology of Lipids, 1831(10), 1518–1532. https://doi.org/10.1016/j.bbalip.2013.03.001
- Weber, D. D., Aminzadeh-Gohari, S., Tulipan, J., Catalano, L., Feichtinger, R. G., & Kofler, B. (2020). Ketogenic diet in cancer therapy. Aging, 12(2), 1640–1664. https://doi.org/10.18632/aging.102833