Now Reading: EEF1AKMT4–EEF1A2K36me3 Yolu ve Safra Kesesi Kanseri İlerlemesi
-
01
EEF1AKMT4–EEF1A2K36me3 Yolu ve Safra Kesesi Kanseri İlerlemesi
EEF1AKMT4–EEF1A2K36me3 Yolu ve Safra Kesesi Kanseri İlerlemesi
Son yıllarda dünyada en sık görülen hepatobiliyer maligniteler arasında yer alan safra kesesi kanseri (SKK), özellikle lenf nodu metastazıyla karakterize agresif ilerleyişi nedeniyle ciddi bir sağlık sorunu olmaya devam etmektedir. Safra kesesi kanserinde moleküler mekanizmaların yeterince aydınlatılamamış olması, etkili hedefe yönelik tedavilerin geliştirilmesini zorlaştırmaktadır. Bu durumu dikkate alan Shandong Üniversitesi’nden araştırmacılar, önemli bir moleküler ekseni ortaya koyan ve SKK’nın ilerleyişi ile metastazında kritik rol oynayan yeni bir çalışmaya imza attılar. Bu çalışma, bilim dünyasında büyük yankı uyandırırken, safra kesesi kanserine yönelik yeni tedavi stratejilerinin geliştirilmesi adına umut vadetmektedir.
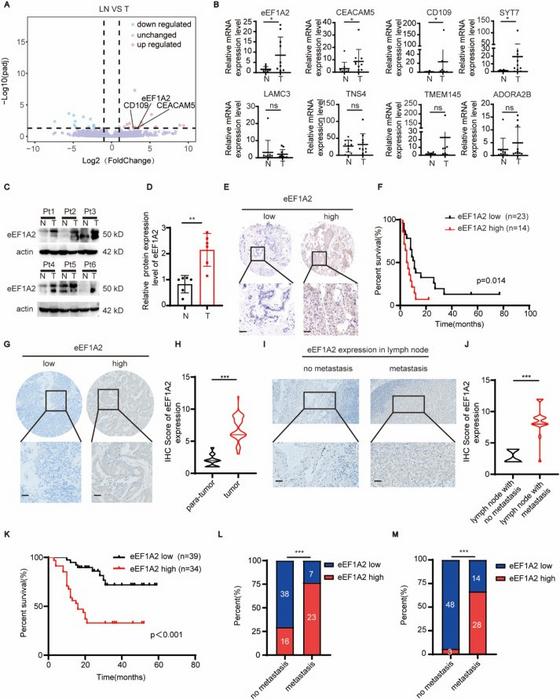
Araştırmanın merkezinde, kanser biyolojisinde protein sentezi mekanizmasının önemli bir aktörü olan ökaryotik çeviri elongasyon faktörü 1A2 (eEF1A2) yer almaktadır. Geleneksel olarak proteinin elongasyon aşamasında görev alan bu faktör, safra kesesi tümör ve metastatik lenf nodu dokuları üzerinde yapılan bütünleşik transkriptom analizleriyle, metastazlı tümörlerde belirgin şekilde artmış düzeyde bulundu. Bu artışın, hastaların kötü prognozu ile güçlü bir korelasyon sergilemesi eEF1A2’nin agresif hastalık fenotiplerinin biyobelirteci olabileceği ihtimalini gündeme getirdi.
Çalışmanın bir diğer önemli ayağı, eEF1A2’nin safra kesesi kanseri hücrelerindeki işlevsel rolünü ortaya koymak adına gerçekleştirilen fonksiyonel deneylerdir. RNA aracılı interferans yöntemiyle eEF1A2’nin susturulması, tümör hücrelerinin göç ve invazyon yeteneklerini belirgin biçimde azalttı. Buna karşın eEF1A2’nin aşırı eksprese edilmesi bu malign özellikleri artırdı. Bu bulgular, in vitro model sistemlerinde gözlenmesinin ötesine geçerek in vivo deneylerde de doğrulandı. eEF1A2’nin susturulması, tümör büyümesini ve lenf nodu metastaz oluşumunu engellerken, aşırı ifade hem tümör proliferasyonu hem de metastatik yayılım üzerinde uyarıcı etki gösterdi.
Çalışma, eEF1A2’nin kanser biyolojisindeki işlevselliğinin yalnızca ekspresyon düzeyiyle sınırlı kalmadığı, aynı zamanda post-translasyonel modifikasyonlarla da düzenlendiğini ortaya koydu. Özellikle lizine bağlı metilasyonun önem kazandığı çalışmada, K36 ve K55 olarak adlandırılan iki kritik lizindenin safra kesesi kanser hücrelerinde hipermetile olduğu tespit edildi. Bu metilasyonların katalizörlüğünü üstlenen EEF1AKMT4 metiltransferaz enzimi ise tumor dokularda aşırı eksprese edilmekteydi. En zengin etki gösteren metilasyon, eEF1A2’nin K36 pozisyonunda gerçekleşirken, EEF1AKMT4 susturulduğunda malign hücresel davranışlarda azalma yaşandı ancak bu enzimin aşırı üretimi tek başına tümör oluşumunu tetiklemedi; bu da enzimin tümör biyolojisindeki karmaşık ve koşula bağlı rolünü işaret etmektedir.
Moleküler düzeyde yapılan mekanistik çözümlemelerde, eEF1A2’nin K36 trimetilasyonunun GTPaz aktivitesini belirgin biçimde artırdığı belirlendi. Bu biyokimyasal etkinin sonucu olarak, hücrelerde pro-survive ve proliferasyon yolaklarından ERK1/2 ile AKT sinyal yolları aktifleşti. Bu aktivasyon, ribozomal protein senteğinin hızlanmasına yol açarak hızlı bölünen kanser hücrelerinin artan biyokütle ve metabolik ihtiyaçlarını karşılamalarına olanak sağladı. Ayrıca, EEF1AKMT4 ekspresyonunun tekrar sağlanması, susturulmuş hücrelerde proliferatif ve invazif fenotiplerin geri kazanımını mümkün kıldı ki bu durum metilasyonun biyolojik özgüllüğünü ve ehemmiyetini pekiştirdi.
Araştırma, evrimsel olarak korunan bir moleküler mekanizmayı gün yüzüne çıkardı: EEF1AKMT4-eEF1A2 K36 trimetilasyonu üzerinden ribozomal protein sentezini tetikleyen bu zincirleme süreç, safra kesesi kanserinin ilerlemesi ve lenf nodu metastazında etkili bir belirleyici olarak işlev görüyor. Kanser mikroçevresinde bu artan ribozomal protein üretimi, onkojenik proteinlerin sentezini hızlandırarak, tümörün agresif davranışını desteklemektedir. Dolayısıyla, bu yolun hedeflenmesi tümör büyümesini ve metastatik yayılımı engellemede önemli bir strateji oluşturmaktadır.
Klinik boyutta da eEF1A2’nin önemi immünohistokimyasal analizlerle büyük hasta gruplarında doğrulandı. Yüksek eEF1A2 düzeyine sahip tümörler, hastaların genel sağkalım oranlarının anlamlı şekilde düşmesi ile ilişkilendirildi. Aynı zamanda, eEF1A2 ekspresyonu ile lenf nodu metastaz sıklığı arasında pozitif korelasyon bulunması, faktorun tümörün invazivliğini artıran bir modülatör olduğunu desteklemektedir.
Literatürde hedefe yönelik moleküler tedavi uygulamalarının safra kesesi kanserinde sınırlı olması göz önüne alındığında, bu çalışmanın ortaya koyduğu moleküler eksenin ilaç geliştiricilere yeni ufuklar açması beklenmektedir. Her ne kadar eEF1A2 ve EEF1AKMT4 inhibitörleri henüz ticari olarak mevcut olmasa da, translasyonel mekanizmanın bu epigenetik modifikasyonla regülasyonu, ilaç keşif çabalarına hız verecektir.
Sonuç olarak, bu araştırma, protein sentez faktörlerinin sadece klasik görevlerinin ötesinde, epigenetik kontrol mekanizmalarıyla tümörün agresifleşmesini desteklediğini net bir biçimde göstermektedir. eEF1A2’nin lizine bağlı metilasyonunun kanser biyolojisindeki bu kritik rolü, sadece safra kesesi kanseri için değil, diğer maligniteler açısından da geniş kapsamlı yeni araştırmalara kapı aralamaktadır. Bu düzenleyici ağın hedeflenmesiyle kanser hücrelerinde büyüme ve metastaz mekanizmalarının bozulması, hastaların yaşam kalitesinin artırılması açısından dönüştürücü bir yaklaşım olabilir.
Tıbbın güncel zorluklarından biri olan safra kesesi kanserinin geç evrede tanısı ve kemoterapiye direnç durumu, yeni moleküler bilgilerle aşılma yolundadır. EEF1AKMT4-eEF1A2-K36 trimetilasyonu ile ribozomal protein sentezinin artışını sağlayan bu yeni bulgu, kanser progresyonuna giden yolu ve metastazı daha derin anlamamızı sağlamış, böylece hedefe yönelik kişiselleştirilmiş tedavi yaklaşımlarının önünü açmıştır. Gelecekte geliştirilecek küçük molekül inhibitörleri veya antikor bazlı terapiler, bu eksenin kontrol altına alınmasını sağlayarak, güvenilir tedavilerin temelini oluşturabilir.
Özetle, Shandong Üniversitesi’nin bu dikkate değer çalışması, translasyon elongasyon faktörlerinin kanser biyolojisindeki beklenmedik rollerini ve epigenetik regülasyonun tümör ilerleyişindeki merkezi yerini gözler önüne sermiştir. Kanser hücrelerinde protein sentezinin düzenlenmesi, metastazın tetiklenmesindeki kilit unsurlardan biri olarak tanımlanmıştır. Bu paradigma değişikliği, sadece safra kesesi kanseri için değil, tüm onkoloji alanı için moleküler biyolojinin en kritik konularından biri haline gelmiştir. Yayımlanan bu çalışma, hem bilimsel merakları tatmin eden hem de klinik sonuçları iyileştirmeye yönelen değerli içeriklerle dolu olmakla birlikte, onkoloji dünyasında yeni bir dönemin habercisi niteliğindedir.
—
**Araştırma Konusu**: Moleküler mekanizmalar aracılığıyla safra kesesi kanserinde lenf nodu metastazının incelenmesi.
**Makale Başlığı**: EEF1AKMT4-eEF1A2 synergistically facilitates the progression of GBC by promoting ribosomal protein output
**Web References**:
https://www.sciencedirect.com/journal/genes-and-diseases
https://www.editorialmanager.com/gendis/default.aspx
**Doi Referans**: 10.1016/j.gendis.2025.101619
**Resim Credits**: Genes & Diseases
**Anahtar Kelimeler**: Safra kesesi kanseri, lenf nodu metastazı, eEF1A2, EEF1AKMT4, lizine bağlı metilasyon, translasyon elongasyon faktörü, ribozomal protein sentezi, ERK1/2 sinyal yolu, AKT yolu, kanser progresyonu, post-translasyonel modifikasyon, kanser biyobelirteçleri