Now Reading: Antimalaryal İlaç Genetik Hastalıklarda Umut Vaadediyor
-
01
Antimalaryal İlaç Genetik Hastalıklarda Umut Vaadediyor
Antimalaryal İlaç Genetik Hastalıklarda Umut Vaadediyor
Genetik hastalıkların tedavisinde devrim yaratabilecek yeni bir araştırma, uzun yıllardır malarya tedavisinde kullanılan meflokin adlı ilacın, prematür durdurma kodonlarına (stop kodonlarına) bağlı hastalıklarda kullanılabileceğini ortaya koydu. Prematür stop kodonları, hücrelerin protein sentezini erken durdurarak eksik ve işlevsiz proteinlerin oluşmasına neden olur. Bu durum, kistik fibroz, Duchenne musküler distrofi (DMD) gibi genetik hastalıklar ve bazı kanser türlerinin temel mekanizmalarından biri olarak kabul ediliyor. Uluslararası bir araştırma ekibi, Groningen Üniversitesi’nden Prof. Albert Guskov öncülüğünde, meflokinin aminoglikozidler adlı başka ilaçlarla birlikte kullanıldığında bu hatalı durdurma sinyallerinin daha etkin şekilde atlanmasını sağladığını keşfetti.
Genetik mutasyonların proteinin üretimini erken sonlandırması, hücre fonksiyonlarında ciddi bozukluklara yol açar. Normalde, mRNA üzerindeki stop kodonları ribozomu proteini tamamlamadan durdurur ve böylece işlevsel protein oluşmaz. Aminoglikozidler ise bu durumun atlanmasına, yani “okuma devamlılığı”na olanak tanır; ancak bu antibiyotiklerin etkili dozları genellikle böbrek ve kulak gibi hayati organlarda ciddi toksik yan etkilere sebep olur. Bu yan etkiler, aminoglikozidlerin genetik hastalıkların tedavisinde yaygın uygulanmasını kısıtlamıştır.
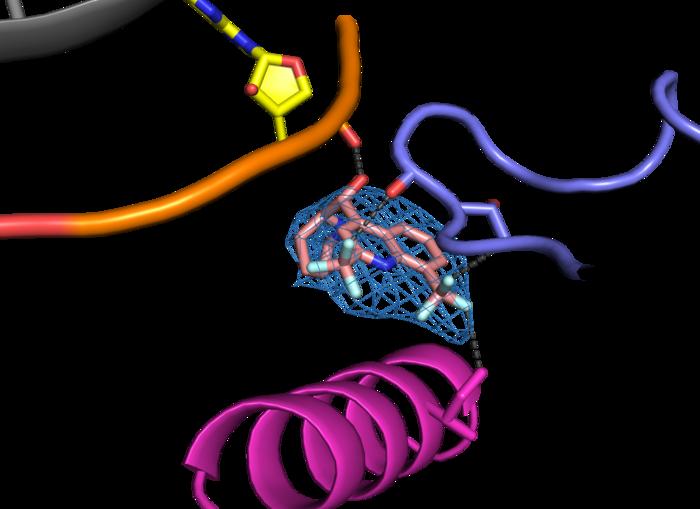
Araştırmada, meflokinin aminoglikozidlerle kombinasyon halinde kullanılması sayesinde, aminoglikozid dozunun düşürülebildiği ve bu sayede toksik etkilerin azaltılabildiği gösterildi. Bu sayede protein sentezi hatalı durdurma sinyallerinin önüne geçerek tam uzunlukta, fonksiyonel protein yapımı mümkün hale geliyor. Elektron cryo-mikroskobi gibi ileri düzey yapısal biyoloji teknikleri kullanılarak meflokinin ribozom üzerindeki bağlanma yeri belirlendi. Daha önce bilinmeyen bu bölge, ribozomun şekil ve hareket dinamiklerinde ince değişiklikler yaratarak yanlış stop kodonlarının okunmasını kolaylaştırıyor.
Meflokinin etkisinin moleküler düzeyde anlaşılması, bu ilacın yeniden kullanımı ve benzer bileşiklerin geliştirilmesi için kritik bir adımı temsil ediyor. Meflokinin ribozom üzerindeki yeni bağlanma bölgesi, ribozomun hareketliliğini artırarak, yanlış stop kodonunda yanlış eşleşen tRNA’nın bağlanma olasılığını yükseltiyor. Böylece ribozom, erken sonlanan sentez reaksiyonunu atlayarak proteini doğru şekilde tamamlayabiliyor. Araştırma ekibi tarafından oluşturulan yapısal haritalar, meflokinin ribozom üzerinde stabilize ettiği konformasyonları açık bir şekilde göstermektedir.
Bu bulgu, aminoglikozidler ve meflokinin hücre kültürü çalışmalarıyla gözlemlenen sinerjisini açıklamakta, ancak önce moleküler bazda bilinmeyen bir mekanizmaydı. Meflokinin spesifik bağlanma bölgesinin ortaya çıkarılması, yapıya dayalı ilaç tasarımı yoluyla daha etkili, güvenli moleküllerin geliştirilmesine kapı aralıyor. Böylece, bugüne kadar ilaç tedavisiyle çözümlenemeyen genetik kod hataları için yeni bir tedavi stratejisi tasarlanabilecek.
Özellikle kistik fibroz hastalarında CFTR genindeki prematür stop mutasyonları nedeniyle iyon kanalları işlevsiz hale geliyor. Bu yeni yaklaşım, protein sentezinin yeniden sağlanmasıyla kısmi fonksiyonun geri kazanılmasını mümkün kılabilir. Benzer şekilde, DMD gibi ölümcül kas hastalıklarında dystrophin genindeki prematür stop kodonlarının atlanması, hastalığın seyrini yavaşlatabilir ve hastaların yaşam kalitesini artırabilir. Bu hastalıklar için mevcut tedavi seçeneklerinin yetersizliği göz önünde bulundurulduğunda, meflokin-aminoglikozid kombinasyonunun önemi daha da artıyor.
Kanser tedavisinde de yeni ufuklar açılabilir. Bazı tümörlerde tümör baskılayıcı genlerde oluşan prematür stop mutasyonları, bu genlerin işlevini yitirip kanser hücrelerinin kontrolsüz çoğalmasına yol açar. Meflokinin aminoglikozidlerle birlikte kullanımı, ribozomun bu yanlış durdurma sinyallerini atlayarak tümör baskılayıcı proteinlerin yeniden üretilebilmesini sağlayabilir. Böylece, kanser hücrelerinin büyümesi engellenebilir veya diğer tedavilerle kombine edilerek etkinlik artırılabilir.
Ancak, laboratuvar bulgularının klinik uygulamaya dönüştürülmesi için öncelikle hücre modellerinde ve hayvan deneylerinde kapsamlı testler yapılması gerekiyor. Prof. Guskov ve ekibi, bu kombinasyonun doz optimizasyonu, etkinlik ve güvenlik profilinin detaylı şekilde incelenmesinin zorunlu olduğunu vurguluyor. İnsan klinik denemeleri öncesi bu aşama, terapötik başarının anahtarı olacak. Ayrıca, ribozomun doğruluk mekanizmalarının manipülasyonu tüm hücrelerde yan etkiler oluşturabilir; bu yüzden ilaç kinetiği ve dinamiği titizlikle değerlendirilmeli.
Araştırma aynı zamanda ribozomun yapısal esnekliğinin ve hareket dinamiklerinin daha iyi anlaşılmasına da katkı sağlıyor. Bu alan, daha önce yeterince keşfedilmemiş olan protein sentezinin düzenlenmesine yönelik yeni ilaç hedeflerini ortaya çıkarabilir. Meflokinin bağlanma bölgesi gibi yeni hedeflerin bulunması, ilaç geliştirme sürecinde farklı moleküllerin tasarlanması için ilham kaynağı olacaktır.
Temel bilimle farmakolojinin başarılı entegrasyonunu gösteren bu çalışma, genetik hastalıkların tedavisinde yeni bir paradigma oluşturabilir. Prematür stop kodon okuma hatalarını gideren ilaçların geliştirilmesi, gen terapileriyle birlikte tamamlayıcı bir çözüm sunarak hastalara umut verecektir. Bu, sofistike yapısal biyoloji ve ilaç kimyasının birlikte kullanıldığı nadir ve umut verici başarı örneklerinden biridir.
Guskov, çalışmanın tesadüfi keşiflerle gelişen bilimsel merakın sonucunda ortaya çıktığını belirtiyor. Son teknoloji yüksek çözünürlükte elektron mikroskobu yöntemleri, uzun zamandır cevapsız kalan biyomedikal sorulara yanıt üretme gücünü gösteriyor. Bu ilerleme, geleceğin genetik hastalık tedavilerinde kullanılacak yeni nesil moleküllerin tasarlanması için teminat oluşturuyor.
Bununla birlikte, ribozom işleyişinde uzun vadeli müdahalelerin hücre sağlığı ve genetik stabilite üzerindeki etkileri dikkatle izlenmelidir. İstenmeyen yan etkilerden kaçınmak için farmakokinetik ve farmakodinamik profil optimum hale getirilmeli ve terapötik pencereler net çizilmelidir. Böylece faydalı etki, hücrelerin temel işlevlerini bozmayacak şekilde sağlanabilir.
Sonuç olarak, meflokinin aminoglikozidler ile kombinasyonunun prematür durdurma kodonlarının atlanmasında yarattığı etki, genetik hastalıkların ve bazı kanserlerin tedavisinde büyük bir kırılma noktası olabilir. Bu yaklaşım, uzun süre ilaçla tedavisi mümkün olmayan hastalara yeni umut kapıları açabilir. Genetik kodun bu tür hatalarının düzeltilmesi, modern tıbbın en zorlu meydan okuması olarak görülse de, bu çalışma gelecekte bu engelin aşılacağının sinyallerini veriyor.
—
Araştırma Konusu:
Prematür stop kodonları içeren genetik hastalıklarda ribozomal protein sentezinin devam ettirilmesi ve meflokinin aminoglikozidlerle sinerjik etkisi.
Makale Başlığı:
Mechanism of read-through enhancement by aminoglycosides and mefloquine
Haberin Yayın Tarihi:
25 Nisan 2025
Web References:
http://dx.doi.org/10.1073/pnas.2420261122
Doi Referans:
10.1073/pnas.2420261122
Resim Credits:
Albert Guskov, University of Groningen
Anahtar Kelimeler:
Genetik hastalıklar, prematür stop kodon, meflokin, aminoglikozidler, protein sentezi, kistik fibroz, Duchenne musküler distrofi, kanser tedavisi, ilaç yeniden kullanımı, yapısal biyoloji, translasyon hataları, moleküler tıp.

























