Now Reading: HER3: Kanser Tedavisinde Yeniden Öne Çıkan Kritik Hedef
-
01
HER3: Kanser Tedavisinde Yeniden Öne Çıkan Kritik Hedef
HER3: Kanser Tedavisinde Yeniden Öne Çıkan Kritik Hedef
Kansere yönelik tedavi yaklaşımlarında ErbB reseptör tirozin kinaz ailesi uzun süredir önemli bir araştırma konusu olmuştur. Bu aile içinde yer alan HER3 (İnsan Epidermal Büyüme Faktörü Reseptörü 3), geçmişte yetersiz kinaz aktivitesi nedeniyle önemsiz bir üye olarak görülmüştür. Ancak son yıllarda yapılan çalışmalar, HER3’ün sadece pasif bir reseptör olmadığını, aksine tümör büyümesi, metastaz ve tedavi direncinde etkin bir rol üstlenen güçlü bir sinyal düzenleyicisi olduğunu ortaya koymuştur. Bu durum, HER3 biyolojisinin tedavi alanında yeniden değerlendirilmesini zorunlu kılmıştır.
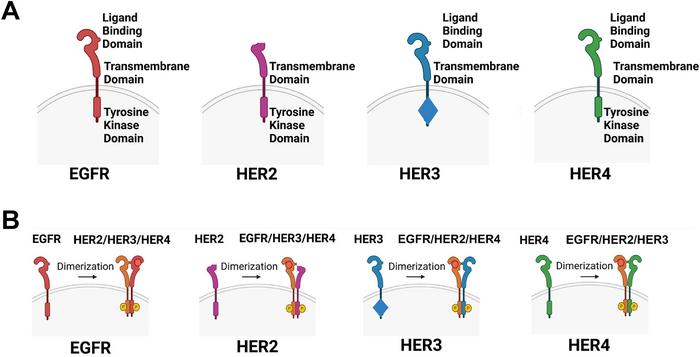
HER3’ün önemi, diğer ErbB üyeleri, özellikle HER2 ile yaptığı heterodimerizasyon sayesinde artmaktadır. HER3 kendi başına fonksiyonel bir kinaz aktivitesine sahip olmasa da, sitoplazmik bölgesinde PI3K’nin p85 alt ünitesi için birçok bağlanma bölgesi bulunur. Bu sayede, HER3 diğer reseptörlerle dimerleştiğinde PI3K/Akt yolunu güçlü bir şekilde aktive ederek, hücre proliferasyonu ve hayatta kalma süreçlerine doğrudan etki eder. Bu benzersiz işlev, HER3’ü kanser biyolojisinde önemli bir sinyal amplifikatörü haline getirir.
HER3 heterodimerlerinin tetiklediği sinyal yolları arasında MAPK ve PI3K/Akt yolakları ön plana çıkar. Bu yollara bağlı sinyal aktivasyonu, hücre döngüsünün hızlanması, apoptotik programların engellenmesi ve metastatik yayılımın desteklenmesi gibi kanserin temel özelliklerini beslemektedir. HER3’ün aşırı ekspresyonu ya da mutasyonları, özellikle meme, akciğer, kolorektal, pankreas ve jinekolojik kanser türlerinde agresif hastalık seyri ile ilişkilendirilmektedir.
Klinik açıdan bakıldığında, HER3 ekspresyonunun yüksek olduğu hastalarda hasta prognostik tablosu genellikle olumsuzdur. Ayrıca, bu hasta gruplarında klasik tedavilere karşı direnç gelişimi sıklıkla gözlemlenmektedir. Bu durum, HER3’e yönelik terapötik stratejilerin geliştirilmesini hızlandırmıştır. Monoklonal antikorlar ve küçük moleküller kullanılarak ligand bağlanmasının ya da reseptör dimerizasyonunun engellenmesine yönelik yaklaşımlar denenmiş, ancak bu tedaviler çoğunlukla etkili sonuçlar vermemiştir.
Bu sınırlamaların temelinde, HER3 sinyal bağımlılığı konusunda tüm hasta tümörlerinin homojen olmaması yatmaktadır. HER3 ekspresyonu saptansa da, tümörlerin sadece bir kısmı bu sinyale bağımlı “addicted” olarak tanımlanabilir. Özellikle neuregulin-1 (NRG1) füzyon genleri ya da yüksek HER3 reseptör yoğunluğu gibi belirteçler bu bağımlılığın göstergeleri olarak değerlendirilmektedir. Bu nedenle, hastaların tedaviye yanıt verebilme potansiyelini net olarak ortaya koyabilecek daha hassas ve güvenilir prediktif biyobelirteçlerin geliştirilmesi gerekmektedir.
Tümör mikroçevresinin de HER3 aktivasyonunda kritik bir rol oynadığı anlaşılmıştır. Fibroblastlar ve karaciğer endotelyal hücreleri gibi stromal unsurlar, klasikten farklı parakrin sinyallerle HER3’ü aktive edebilmektedir. Bu mekanizma, tümör hücrelerinin hedefe yönelik tedavilere karşı korunmasını sağlar ve bu durum direnç gelişimini ve hastalık nüksünü kolaylaştırır. Dolayısıyla hem tümör hücresel hem de mikroçevresel bileşenlerin tedavi stratejilerine dahil edilmesi önem arz etmektedir.
Bu karmaşık biyolojik yapının üstesinden gelmek için geliştirilen yeni nesil terapötik yaklaşımlardan biri, HER3’e yönelik antikor-ilaç konjugatlarıdır (ADC). Bu moleküller, HER3’e özgü antikorları sitotoksik ajanlarla birleştirerek, tümör hücrelerine spesifik sitotoksisite sağlar. Böylece, hem sağlıklı dokular korunmakta hem de dirençli tümör hücrelerinin etkin şekilde yok edilmesi hedeflenmektedir. Meme ve akciğer kanserlerinde yapılan erken dönem klinik çalışmalar, bu tedavilerin gelecek vadettiğini göstermektedir.
HER3 ekspresyonunun doğru değerlendirilmesi de klinik uygulamada büyük önem taşımaktadır. Hem niceliksel hem de niteliksel analizlerin yapıldığı bu süreç, HER3 pozitif tümörü olan hastaların uygun şekilde seçilmesini sağlayarak, tedavi etkinliğinin artırılmasına hizmet eder. Bu biyobelirteç bazlı hasta stratifikasyonu, onkolojide kişiye özel tedaviler yaklaşımının güçlenmesine önemli katkılar sunar.
HER3 biyolojisinin moleküler düzeyde daha derinlemesine anlaşılmasıyla; bu reseptörün fosforilasyon örüntüleri, dimerizasyon partnerleri ve aşağı akış sinyal etkileyicileri arasındaki ilişkiler detaylandırılmaktadır. Bu gelişmeler, HER3 hedefli terapötik yaklaşımlarda daha önce gözden kaçan zayıf halkaların tespit edilmesine ve yeni ilaç hedeflerinin açığa çıkmasına olanak tanımaktadır. Böylece HER3, sadece kanser sinyal ağına katkı sağlayan bir molekül değil, aynı zamanda dinamik ve müdahale edilebilir bir tedavi hedefi olarak konumlanmaktadır.
Onkoloji alanında “ilaç verilemez” olarak tanımlanan hedeflerin yeni teknolojiler ve biyolojik bilgiler ışığında yeniden ele alınmasının başında HER3 gelmektedir. Gelişmiş tanı yöntemleri, inovatif ilaç tasarımları ve tümör mikroçevresi dinamiklerinin gözetilmesiyle oluşturulan tedavi algoritmaları, HER3’ün klinik başarısını artırmanın önündeki engelleri kaldırmaktadır. Bu yeni paradigmada HER3, dirençli katı tümörler için anahtar hedeflerden biri olma potansiyelini taşımaktadır.
Bu değişim, bilimsel dogmaların sorgulanması ve mekanistik yaklaşımlarla klinik uygulamanın dönüştürülmesinin önemini vurgular niteliktedir. HER3’ün eski önemsenmeyen bir reseptörden, bugün gelişmekte olan ve tercih edilen hedeflerden biri haline gelmesi, kanser araştırmalarındaki sürekli yenilik ihtiyacını gözler önüne sermektedir. Yeni geliştirilen HER3-dirençli ajanların klinik deneylerde ilerlemesiyle, yakın gelecekte bu moleküle yönelik tedavilerin hasta yaşam kalitesini artırması beklenmektedir.
Gelecekte HER3’e yönelik terapilerde, eşzamanlı olarak etkinleştirilen yolların ve tümör mikroçevresinin dikkate alındığı çok boyutlu protokollerin önemi artacaktır. Bu entegrasyon, hem etkinliği yükseltecek hem de uzun süredir kanser tedavisini zorlayan direnç mekanizmalarını aşmada büyük avantaj sağlayacaktır. Dolayısıyla, HER3 hedefli tedavilerin başarıya ulaşması klinik adaptasyonun ve moleküler hassasiyetin birleşimine bağlıdır ve bu durum onkolojinin yeni nesil yaklaşımlarının bir temsilcisidir.
Sonuç olarak, HER3 biyolojisinin kapsamlı şekilde klinik uygulamalara aktarılması, tedaviye dirençli solid tümörlerle mücadelede önemli bir dönüm noktası oluşturacaktır. Bu alan, moleküler doğruluk ve klinik esneklik prensiplerini birleştiren yaklaşımların benimsenmesiyle, kanser tedavisinde yeni bir sayfanın açıldığı kritik bir öneme sahip olacaktır.
—
Araştırma Konusu: HER3 reseptör biyolojisi ve kanser progresyonu ile tedavi direncindeki rolü
Makale Başlığı: HER3: Unmasking a twist in the tale of a previously unsuccessful therapeutic pursuit targeting a key cancer survival pathway
Haberin Yayın Tarihi: 2024
Web References: Genes & Diseases, Volume 12, Issue 4, 2025, Article No. 101354
Doi Referans: 10.1016/j.gendis.2024.101354
Resim Credits: Genes & Diseases
Anahtar Kelimeler: HER3, ErbB reseptör ailesi, kanser progresyonu, tedavi direnci, antikor-ilaç konjugatları, tümör mikroçevresi, PI3K/Akt yolu, MAPK yolu, prediktif biyobelirteçler, neuregulin-1 (NRG1), kişiselleştirilmiş onkoloji