Now Reading: METTL3, Tümör Baskılayıcı Genleri Susturarak Oral Kanser İlerlemesini Destekler
-
01
METTL3, Tümör Baskılayıcı Genleri Susturarak Oral Kanser İlerlemesini Destekler
METTL3, Tümör Baskılayıcı Genleri Susturarak Oral Kanser İlerlemesini Destekler
Son yıllarda kanser araştırmalarında RNA bazlı epigenetik düzenlemeler önemli bir odak noktası haline gelirken, Hindistan’daki Birla Teknoloji ve Bilim Enstitüsü’nden bilim insanları, ağız ve boğaz bölgesinde görülen, yüksek agresifiteye sahip bir kanser türü olan oral skuamöz hücreli karsinomun (OSCC) ilerlemesini etkileyen yeni bir moleküler ekseni ortaya koydu. Bu çığır açan çalışmada, METTL3 isimli bir RNA metiltransferaz enziminin, RNA üzerindeki N6-metiladenozin (m6A) işaretlemeleri yoluyla gen regülasyonunu etkileyerek OSCC gelişimini hızlandırdığı tespit edildi. Araştırmanın detayları, METTL3’ün miR-146a-5p/SMAD4 eksenini nasıl düzenleyerek tümör baskılayıcı işlevi giderek ortadan kaldırdığını ve böylelikle hastalığın ilerlemesini nasıl kolaylaştırdığını gözler önüne seriyor.
Oral skuamöz hücreli karsinom, genellikle geç tanı konması ve hızla yayılması nedeniyle dünya çapında yüksek ölüm oranlarına sahip kritik bir klinik problemdir. Araştırmanın merkezinde yer alan METTL3, RNA üzerindeki m6A modifikasyonlarını gerçekleştiren başlıca enzimlerden biridir. Bu epigenetik modifikasyonlar, RNA moleküllerinin kararlılığını, işlenmesini, çeviri etkinliğini ve yıkımını kontrol ederek, hücre içi gen ifade mekanizmalarını post-transkripsiyonel düzeyde düzenler. METTL3’ün çeşitli kanser türlerinde artmış aktivitesi rapor edilse de, OSCC bağlamında bu enzimin rolü üzerinde önceki bilgiler oldukça sınırlıydı.
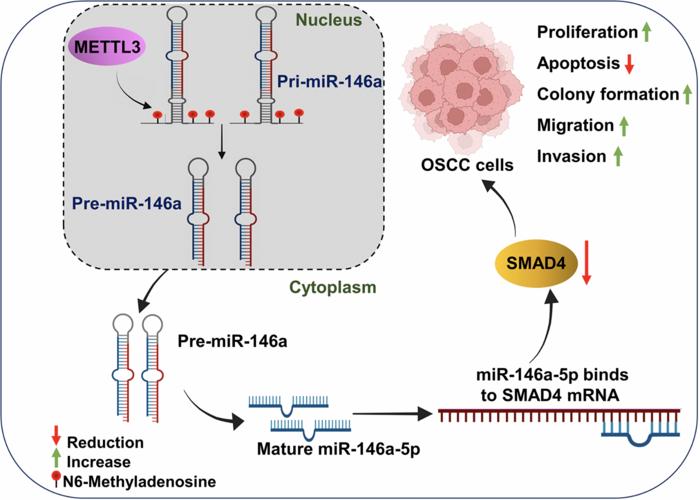
Araştırmada, OSCC hücrelerinde METTL3’ün belirgin şekilde yükseldiği ve buna bağlı olarak global m6A metilasyonunun arttığı saptandı. Bu artış, pri-miR-146a öncül mikroRNA’sının olgun miR-146a-5p formuna dönüşümünü hızlandırdı. miR-146a-5p, hücre içi gen susturması için kritik işlev gören mikroRNA’lar arasında yer alır ve hedef mRNA’larla baz eşleşmesi yaparak bu moleküllerin yıkımına veya translasyonlarının baskılanmasına yol açar. Burada, miR-146a-5p, genellikle tümör baskılayıcı olarak bilinen SMAD4 genini doğrudan hedefleyerek onun ekspresyonunu azaltmaktadır.
SMAD4, özellikle TGF-β (dönüştürücü büyüme faktörü beta) sinyal ağında merkezi bir rol üstlenen ve hücresel büyüme, farklılaşma ile programlı hücre ölümünü düzenleyen önemli bir tümör baskılayıcıdır. METTL3 kaynaklı artan m6A modifikasyonlarıyla artırılan miR-146a-5p ekspresyonu, SMAD4’ün susturulmasını ve sonuç olarak bu kritik tümör baskılayıcı yolun işlevselliğinin bozulmasını sağlamaktadır. Sonuçta, OSCC hücrelerinde proliferasyon hızlanmakta, kolonizasyon yetenekleri artmakta, göç ve invazyon kapasitesi yükselmekte ve apoptosis yani hücre ölümüne karşı direnç gelişmektedir. Bu kapsamlı moleküler bozulma, tümörün daha agresif davranmasına, metastaz yapmasına ve tedaviye direnç göstermesine zemin hazırlamaktadır.
Laboratuvar şartlarında yapılan deneyler, METTL3’ün önemli etkisini doğrulamaktadır. METTL3 susturulduğunda veya enzimatik aktivitesi farmakolojik olarak engellendiğinde, miR-146a-5p seviyelerinde belirgin düşüş gözlenirken, SMAD4 ifadesi geri kazanılmaktadır. Bu moleküler değişim, kanser hücrelerinin büyüme hızını yavaşlatmakta ve hücre ölümüne karşı duyarlılığını artırmaktadır. İlginç olan ise, miR-146a-5p’nin tekrar hücrelere verildiğinde ya da SMAD4 gen ifadesi engellendiğinde, bu faydalı etkilerin tersine dönmesidir. Böylece, METTL3-miR-146a-5p-SMAD4 ekseninin OSCC progresyonunda kritik ve zorunlu bir rolü olduğu kesin olarak ortaya konmuştur.
Bu bulgular, özellikle OSCC tedavisinde yeni hedeflerin açığa çıkması açısından büyük umut vaat etmektedir. METTL3 enzim aktivitesini engelleyen STM2457 adlı küçük molekül inhibitör, akut miyeloid lösemi gibi diğer kanser türlerinde araştırılmış ve etkili bulunmuştur. Benzer şekilde, OSCC hücrelerinde METTL3’ü hedefleyen moleküler tedavilerin geliştirilmesi ve miR-146a-5p’nin blokajı veya SMAD4 ekspresyonunun geri kazandırılması gibi stratejiler, mevcut tedavilere kıyasla çok daha etkili sonuçlar verebilir. Böylelikle, tümör büyümesini ve yayılımını önlemek mümkün hale gelebilir.
Araştırmanın bir diğer önemi ise RNA epigenetiğinin, yani RNA üzerinde gerçekleşen kimyasal değişikliklerin, kanser biyolojisindeki karmaşık rolüne ışık tutmasıdır. m6A metilasyonları gibi epitranskriptomik mekanizmalar, kanser hücreleri tarafından hayatta kalma ve çoğalma için ustaca kullanılmaktadır. Bu çalışma, post-transkripsiyonel modifikasyonların mikroRNA regülasyonunu da etkileyerek, tümör oluşumunda ne denli belirleyici olabileceğini göstermiştir. RNA metilmomikleri alanındaki bu tür araştırmalar, epigenetik ve genetik düzenleyicilerin nasıl kesiştiğini daha iyi anlamamıza olanak sağlayacaktır.
Ayrıca, OSCC’nin tedaviye dirençli oluşunun moleküler tabanının bu çalışmayla kısmen açıklanmış olması, gelecekte daha entegre ve hedefe yönelik tedavi yaklaşımlarının önemini ortaya koyuyor. Geleneksel kemoterapi ve radyoterapiye ek olarak epigenetik ve RNA odaklı tedavilerin geliştirilmesi, hastaların tedaviye yanıtını artıracak, tekrarlayan hastalık riskini azaltacak ve hasta yaşam kalitesini yükseltecektir. Bu bağlamda, METTL3/miR-146a-5p/SMAD4 ekseni, yeni nesil kişiselleştirilmiş anti-kanser stratejilerinin merkezinde yer alabilir.
Klinik açıdan bakıldığında, METTL3 ve miR-146a-5p’nin normalden yüksek, SMAD4’ün ise düşük seviyelerde bulunması OSCC için prognostik ve tanısal biyobelirteç olarak kullanılabilir. Kan damarlarında ya da diğer sıvılarda yapılacak non-invaziv testlerle bu moleküllerin izlenmesi, hastalığın erken tespiti ve tedavi planlamasında kritik rol oynayabilir. Böylelikle, OSCC nedeniyle yaşanan can kayıpları azalabilir ve hastaların yaşam süresi uzatılabilir.
Sonuç olarak, Jayaprakash, Karemore ve Khandelia tarafından yürütülen bu araştırma, OSCC ilerleyişini şekillendiren yeni bir moleküler yol olan METTL3/miR-146a-5p/SMAD4 eksenini ortaya koyuyor. RNA metilmomiklerindeki düzensiz artışın ve sonraki mikroRNA regülasyonunun tümör baskılayıcı genlerin susturulmasını tetikleyerek, kanser hücrelerinin agresif özellikler kazanmasına neden olduğu ayrıntılı biçimde gösterildi. Bu eksenin bileşenlerini hedefleyen tedaviler, OSCC üzerinde çığır açıcı etkiler yaratabilir.
RNA epigenetiğinin kanser araştırmalarında gelişen önemi göz önüne alındığında, METTL3 gibi RNA düzenleyici enzimlerin modülasyonunun terapötik potansiyeli giderek artmaktadır. Epitranskriptomik değişiklikler, mikroRNA ağları ve tümör baskılayıcı genler arasındaki karmaşık etkileşimlerin anlaşılması, klinisyenlerin hastalıkları daha iyi tanımlamasını, sınıflandırmasını ve tedavi etmesini sağlayacak. Bu yeni dönemde, RNA biyolojisi temelli terapi yaklaşımlarının OSCC gibi zorlu kanser türlerinde devrim yapması beklenmektedir.
—
Araştırma Konusu: Cells
Makale Başlığı: METTL3 promotes oral squamous cell carcinoma by regulating miR-146a-5p/SMAD4 axis
Haberin Yayın Tarihi: 8-May-2025
Web References: http://dx.doi.org/10.18632/oncotarget.28717
Doi Referans: 10.18632/oncotarget.28717
Resim Credits: © 2025 Jayaprakash et al. This is an open access article distributed under the terms of the Creative Commons Attribution License (CC BY 4.0).
Anahtar Kelimeler: kanser, oral kanser, m6A RNA metilasyonu, METTL3, miR-146a-5p, SMAD4