Now Reading: Yaşlanan Bağırsak Mikrobiyotasının Lösemi Riskini Artırması ve Diğer Etkileri
-
01
Yaşlanan Bağırsak Mikrobiyotasının Lösemi Riskini Artırması ve Diğer Etkileri
Yaşlanan Bağırsak Mikrobiyotasının Lösemi Riskini Artırması ve Diğer Etkileri
Yaşlanmayla birlikte bağırsak mikrobiyotasında meydana gelen değişikliklerin, lösemi gelişme riskini artırdığı bilimsel bir çalışma ile ortaya kondu. Cincinnati Children’s Hospital Medical Center öncülüğünde yürütülen ortak araştırmada, bağırsak bariyerinin geçirgenliğinin artması sonucunda, mikrobiyal metabolitlerin kana karışarak, pre-lösemik hücrelerin çoğalmasını tetiklediği belirlendi. Nature dergisinde 23 Nisan 2025 tarihinde yayımlanan bu çalışma, yaşlanma ve kanser biyolojisi alanında yeni paradigmalara kapı aralarken, özellikle yaşa bağlı iltihaplanma ve klonal hematopoezisin (CHIP) sistemik etkileri bakımından önemli çıkarımlar sunuyor. Bu bulgular, yalnızca lösemi değil, kardiyovasküler ve diğer inflamatuar hastalıklarla ilişkili patolojilerin anlaşılmasında da çarpıcı bir ışık tutuyor.
Yaşlanmanın kanser, özellikle kan kanserleriyle olan bağlantısı uzun zamandır biliniyor ancak bu ilişkinin moleküler mekanizmaları tam olarak anlaşılamamıştı. Araştırmada, yaşlandıkça bağırsak duvarının geçirgenliğinin arttığı ve gram-negatif bakteriler tarafından üretilen ADP-heptoz adlı özel bir bakteriyel şeker molekülünün kana sızdığı tespit edildi. Bu molekül, hematopoietik hücrelerde sinyal yolaklarını aktifleştirerek, pre-lösemik hücrelerin klonal olarak genişlemesine olanak sağlıyor. Böylece yaşa bağlı mikrobiyal değişikliklerin doğrudan kanserleşme sürecine katkısı açıklandı.
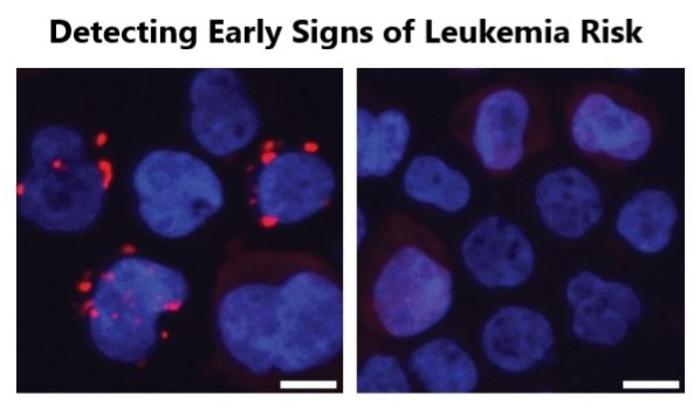
Çalışmada ayrıntılı biçimde hücresel dinamiklere de ışık tutuldu. ADP-heptozun etkisi, TIFA adlı proteinin polimerizasyonuyla oluşan TIFAsom adlı sinyal komplekslerinin kurulmasıyla gerçekleşiyor. Yaşlı bireylerin plazmasına maruz kalan kan hücrelerinde TIFAsom oluşumu belirgin biçimde artarken, gençlerin plazmasında bu durum minimal düzeydeydi. Bu, yaşlanmayla birlikte bağırsak kaynaklı metabolitlerin kan hücrelerinde öncü kanserleşme belirtilerini tetikleyen bir köprü görevi gördüğünü ortaya koyuyor.
Araştırma, insan CHIP hastalarını modelleyen fareler üzerinde yapılan deneylerle desteklendi. CHIP, kan hücrelerinde somatik mutasyonların klonal çoğalmasıyla karakterize bir durum olup, hematolojik kanserler ve kronik inflamasyonu tetikleyebiliyor. Bu fareler ADP-heptozun etkisine karşı yüksek duyarlılık gösterdi ve pre-lösemik hücrelerin sayısında hızlı bir artış gözlendi. Böylece deney hayvanları insandaki klinik senaryoyu başarılı biçimde yansıttı ve çalışma bulgularının translasyonel değerini artırdı.
Moleküler düzeyde, ADP-heptozun etkisinin hücre içinde ALPK1 adlı bir protein kinaz aracılığıyla şekillendiği belirlendi. ALPK1, bu bakteriyel şekerin bağlandığı sitozolik bir sensör olarak işlev görüyor ve TIFAsomun oluşum sürecini başlatıyor. Ancak şu anda ALPK1’i hedef alan herhangi bir klinik ilaç bulunmuyor. Bu nedenle, ALPK1 bazlı doğrudan müdahaleler hâlihazırda mümkün değil ve yeni tedavi stratejilerine ihtiyaç duyuluyor.
Bununla birlikte araştırmacılar arasındaki yenilikçi yaklaşımlar, ALPK1 sinyalini dolaylı yollardan baskılamayı da gündeme getirdi. UBE2N adlı ubiquitin bağlayıcı enzimin inhibitörlerinin, pre-lösemik hücrelerin ADP-heptoz varlığında bile çoğalmasını engellediği keşfedildi. Bu bulgu, ubiquitin yolla ilgili süreçlerin kanser öncesi hücrelerde klonal büyümeyi sınırlandırmak için potansiyel bir hedef olduğunu gösteriyor. Böylece laboratuvarda ilaç keşfi için alternatif moleküler hedefler ortaya çıktı.
CHIP’in sadece kanserle değil, aynı zamanda kardiyovasküler ve metabolik hastalıklarla da yakından ilişkili olduğu bilgisi, bu çalışmanın bulgularıyla pekişti. Özellikle 70 yaş üstü bireylerde yaygınlığı %10-20 arasında değişen CHIP, kronik inflamasyonla bağlantılı sistemik hastalıklara da zemin hazırlıyor. Bu çerçevede yaşlanmanın getirdiği bağırsak mikrobiyotalı dengesizliklerin, genel sağlık üzerine olan etkileri son derece önemli hale geliyor. Sağlıklı bağırsak bariyerinin korunması ve mikrobiyal dengenin sürdürülmesi, yaşa bağlı hastalıkların önlenmesi açısından kritik kabul ediliyor.
Bilim insanları, bu moleküler yolakların erken evrede saptanabilmesi için TIFAsom oluşumunu ölçen yeni biyobelirteçler geliştirdiler. Bu test, ADP-heptoz sinyal aktivitesinin tespiti için özgün bir platform sunarak, riskli hastaların erken tanısına ve tedavi etkinliğinin izlenmesine olanak sağlayabilir. Böylece hem löseminin önlenmesi hem de yaşa bağlı kronik hastalıkların kontrolü hedeflenebilir. Klinik uygulamalar için büyük umut vadeden bu teknolojik gelişme, tanı ve tedavi stratejilerini derinden etkileyebilir.
Şu an için ALPK1’i doğrudan hedef alan ilaçlar yokken, bağırsak sağlığının modifiye edilebilir bir risk faktörü olduğu vurgulanıyor. Diyet müdahaleleri, prebiyotik ve probiyotik kullanımı bağırsak mikrobiyotasını şekillendirme kapasitesine sahip olsa da, CHIP üzerinde net bir klinik fayda sağladığına dair henüz yeterli bilimsel kanıt bulunmuyor. Önümüzdeki dönemde, hangi bakteriyel türlerin ve metabolitlerin hematopoietik hücre klonal genişlemesini teşvik ettiği veya engellediğinin ayrıntılı olarak ortaya konması gerekiyor.
Araştırmanın bilimsel geçerliliği, NIH destekli büyük hibeler ve çeşitli köklü vakıfların katkılarıyla güçlendirildi. Proje, University of Cincinnati, Oxford Üniversitesi ve Texas A&M University gibi saygın kurumların işbirliği ile multidisipliner bir anlayışla yürütüldü. Hücre biyolojisi, moleküler genetik, mikrobiyoloji ve hematoloji alanlarındaki uzmanlarının ortak çalışması, metabolomik, akış sitometrisi ve genomik analizlerin ileri düzeyde kullanılmasını sağladı ve çalışmanın başarısını garantiledi.
Çalışmayı yöneten Dr. Daniel Starczynowski, Kurome Therapeutics ile olan işbirliğini kamuoyuyla paylaşarak, temel bilimden klinik uygulamaya geçişte aktif rol aldığını belirtti. Bu şirket, ALPK1 sinyalini hedefleyen yeni ilaç adayları geliştirmeye çalışıyor. Böylece bulguların laboratuvar ortamından hasta tedavisine taşınması için somut bir yol çizildi. Önümüzdeki yıllarda yaşa bağlı lösemi riskini azaltmaya yönelik yenilikçi tedavi seçeneklerinin hayatımıza girmesi bekleniyor.
Sonuç olarak, bağırsak mikrobiyotası, onun ürettiği metabolitler ve hematopoietik klonal değişimler arasındaki dikkat çekici ilişki, yaşlanan bireylerde lösemi gelişiminin etiyolojisine dair köklü bir bakış açısı getirdi. Bu mekanizmanın ortaya konması, genetik dışı bir risk faktörünü anlamamızı sağladı ve sistemik sağlığın bağırsak ve kan hücreleri arasındaki karmaşık etkileşimlerle şekillendiği fikrini güçlendirdi. Bu alandaki yeni araştırmalar, sağlıklı yaşam süresini uzatmak ve kanser yükünü azaltmak adına önleyici ve tedavi edici stratejiler geliştirilmesine öncülük edecek.
Araştırma Konusu: Human tissue samples
Makale Başlığı: Microbial metabolite drives aging-related clonal hematopoiesis via ALPK1
Haberin Yayın Tarihi: April 23, 2025
Web References: https://www.cincinnatichildrens.org/research/divisions/a/advanced-leukemia-therapies/programs
Doi Referans: 10.1038/s41586-025-08938-8
Resim Credits: Cincinnati Children’s
Anahtar Kelimeler: Leukemia, Intestines, Cardiovascular disease, Disease prevention, Drug research, ADP-heptose, age-related inflammation, aging gut microbiota, leukemia risk, bacterial byproducts, blood cell proliferation, clonal hematopoiesis of indeterminate potential, elderly microbiome, disease progression, gut bacteria, cancer biology, intestinal permeability, blood cancers, leukemia research, aging, microbiota, immune system interactions, cancer research, systemic health effects