Now Reading: İnnovatif Nanoterapi ile Melanom Bağışıklık Yanıtının Güçlendirilmesi
-
01
İnnovatif Nanoterapi ile Melanom Bağışıklık Yanıtının Güçlendirilmesi
İnnovatif Nanoterapi ile Melanom Bağışıklık Yanıtının Güçlendirilmesi
Son yıllarda cilt kanserleri arasında en ölümcül türlerden biri olarak bilinen melanom, tedavi alanında önemli zorluklar yaratmaya devam ediyor. Bu zorlukların temelinde, melanomun tümör mikroçevresinde güçlü bir bağışıklık baskılayıcı ortam oluşturması yatıyor. Bu yüzden bağışıklık kontrol noktası inhibitörleri gibi geleneksel immünoterapi yöntemlerinin etkinliği sınırlı kalabilmektedir. Ancak Çin’in Hefei Fiziksel Bilimler Enstitüleri’nden Prof. WU Zhengyan liderliğindeki araştırma ekibi, Binzhou Tıp Üniversitesi’nden Prof. ZHANG Guilong iş birliğiyle melanoma karşı immünoterapinin etkinliğini önemli ölçüde artıran yeni nesil bir nano-immün agonist geliştirdi. Bu yenilikçi tedavi yaklaşımı, tümör mikroçevresini çok yönlü olarak düzenleyerek bağışıklık sisteminin kanser hücrelerine yönelik saldırısını güçlendirmektedir.
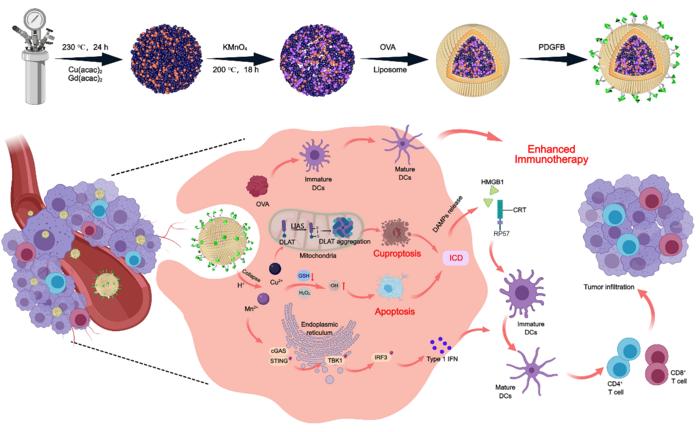
Melanomun yarattığı bağışıklık baskılayıcı ortam, kanser hücrelerinin bağışıklık gözetiminden kaçmasını sağlar, dolayısıyla bağışıklık sisteminin kanserle mücadelesi zorlaşır. Yeni geliştirilen pLCGM-OVA isimli biyobozunabilir nanoplatform, bu problemi aşmak için tasarlandı. pLCGM-OVA sadece doğrudan tümör üzerinde terapötik etkiler yaratmakla kalmıyor, aynı zamanda tümörün biyolojik dokusunu yeniden programlayarak bağışıklık sistemini aktive ediyor. Bu nanomateryalin en yenilikçi yönü, yakın zamanda tanımlanan ‘cuproptosis’ adlı bir programlı hücre ölüm mekanizmasını ve reaktif oksijen türleri (ROS) aracılığıyla immünojenik hücre ölümünü bir arada kullanmasıdır. Bu karmaşık mekanizmalar, tümörün savunma hatlarını içerden çözüp kanser hücrelerini apoptoza yönlendirirken bağışıklık yanıtını da tetiklemektedir.
pLCGM-OVA nanoplatformunun en dikkat çekici özelliklerinden biri, içinde ovalbumin (OVA) adlı modele dayalı bir antijen bulundurmasıdır. OVA, tümöre özgü proteinleri taklit ederek aşı benzeri bağışıklık tepkilerinin oluşmasını sağlar. Nanobotarımı sonrası, OVA epitopları dendritik hücrelere sunulur ve böylece güçlü bir T hücresi primingi gerçekleştirilir. Dahası, nanomateryal hücresel düzeyde sitozolik DNA’yı algılayan ve tip I interferon salgılanmasını düzenleyen cGAS-STING yolunu da aktif hale getirir. Bu yol, antitümör bağışıklık yanıtının tüm vücudu kapsayan bir biçimde harekete geçmesinde kritik rol oynar.
Cuproptosis’in indüksiyonu ve cGAS-STING yolunun aktivasyonunun birleşik etkisi, melanom hücrelerine karşı güçlü bir immunolojik ortam yaratır. İmmünojenik hücre ölümü sayesinde tümör kendi kendine “aşı” görevi görür; böylece, kanser antijenleri ve tehlike sinyalleri bol miktarda açığa çıkar ve bağışıklık sistemi uzun vadeli koruma sağlamak üzere harekete geçer. Bu çift etki hem primer tümör büyümesini baskılar hem de nüks etme riskini azaltarak melanom tedavisinde önemli ilerleme sağlar.
pLCGM-OVA sadece tedavi açısından değil, tanı süreçlerinde de avantajlar sunar. Nanoplatform içinde T₁ ağırlıklı manyetik rezonans görüntüleme (MRI) kontrast ajanları yer alır. Bu sayede tümörün konumu ve tedaviye yanıt gerçek zamanlı olarak izlenebilir. Böyle bir “teranostik” yaklaşım, tedavi ve tanıyı tek bir protokol altında toplamak suretiyle hasta yönetiminde büyük kolaylık ve kişiselleştirilmiş tedavi olanakları sunar.
Biyobozunabilir yapısı sayesinde pLCGM-OVA, terapötik fonksiyonunu tamamladıktan sonra vücutta güvenle metabolize olur. Bu özellik, uzun vadeli toksisite riskini azaltır ve gerektiğinde tekrar dozlamaya olanak sağlar. Klinik uygulamaya geçiş aşamasında biouyumluluk, nanomedisinde en kritik kriterlerden biridir ve bu sistem bu açıdan önemli avantajlar taşır.
Nanoplatformun tasarımı ve sentezi moleküler düzeyde büyük bir titizlikle gerçekleştirilmiştir. Araştırmacılar, tümör ortamında cuproptosis indüklemek için yeterli bakır iyonunu taşırken, OVA moleküllerini ve MRI kontrast elemanlarını aynı anda barındıran stabil, kontrollü salınım özelliklerine sahip ileri bir kolloidal kimya tekniği geliştirdiler. Bu entegre yapı, fizyolojik şartlar altında kararlılığını koruyarak hedefe yönelik etkili tedavi sağlar.
Bu çalışma, nanoteknoloji, immünoloji ve onkoloji disiplinlerinin kesişiminde önemli bir dönüm noktasını simgeliyor. Melanom tedavisindeki çok yönlü zorlukların üstesinden gelirken, bağışıklık baskılanmasını giderme ve hedef hücreye kesinlik kazandırma eksenlerinde yeni nesil terapötik çözümler sunmak adına önemli bir örnek teşkil ediyor. pLCGM-OVA, bu noktada kanser tedavisinin geleceğinde belirleyici olacak multidisipliner yaklaşımların somut göstergesidir.
Promising ön klinik sonuçlar, pLCGM-OVA nano-immün agonistin klinik uygulamalara geçişi için cesaret verici bir temel oluşturuyor. İmmün kontrol noktası baskılayıcılarının ve konvansiyonel aşıların mevcut sınırlarını aşacak bu çift etkili sistem, hem doğrudan tümör hedeflemesi hem de bağışıklık sisteminin kapsamlı uyarılması açısından yeni bir paradigma yaratıyor. Özellikle, cuproptosis ekseninin terapi potansiyelinin keşfedilmesi, kanser tedavilerinde kullanılabilecek benzersiz bir zaafiyet alanı açıyor.
Araştırma ekibi önümüzdeki süreçte dozlama rejimlerini optimize etmeyi, uzun süreli bağışıklık belleği oluşturma kapasitesini değerlendirmeyi ve bağışıklık kaçışı gösteren diğer tümör tipleri üzerinde uygulama olanaklarını incelemeyi planlıyor. pLCGM-OVA nanoplatformunun kişiselleştirilmiş tedavilere yönelik genişleme potansiyeli, hasta özgü tümör antijenlerinin entegre edilmesiyle immünoterapi alanında önemli bir gelişme vaat ediyor.
Bu buluş, kompleks hastalıklarla mücadelede disiplinler arası iş birliğinin önemini vurguluyor. Nanomateryal sentezi, kanser biyolojisi ve immünoterapi alanlarındaki uzmanlıkları bir araya getirerek, vücudun doğal savunma mekanizmalarından faydalanan daha akıllı ve etkin tedavilerin geliştirilmesinin yolunu açtı. Melanom mücadele sürecindeki bu ilerlemeler, hastaların yaşam kalitesini artırma ve hastalıkla mücadelede başarı oranlarını yükseltme potansiyeline sahip.
Çalışmanın sonuçları, saygın bilimsel dergi Journal of Colloid and Interface Science tarafından kabul edilerek yayın sürecine girmiştir. Bu kabul, araştırmanın bilimsel titizlik ve yenilikçilik açısından yüksek standartlarda olduğunu göstermektedir. Melanom gibi ölümcül deri kanserlerine karşı geliştirilen stratejiler, pLCGM-OVA gibi gelişmiş nano immün agonistlerle yeni bir döneme girmektedir.
Tedavi ve tanıyı entegre eden, hastaya özel ve uzun vadeli bağışıklık hafızası yaratabilen bu tür nanoterapötik yaklaşımlar, melanom tedavisinde devrim yaratabilir. Bağışıklık sistemini destekleyen, cuproptosis ile hücre ölümünü tetikleyen ve cGAS-STING yolu yardımıyla kapsamlı bir bağışık yanıtını harekete geçiren bu sistem, modern onkolojide yeni bir umut ışığıdır.
—
Araştırma Konusu: İnovatif nano-immün agonist ile melanom immünoterapisi geliştirilmesi
Makale Başlığı: Biodegradable nano-immune agonist for enhanced immunotherapy of melanoma via the synergistic action of cuproptosis and cGAS-STING enhanced immune response
Haberin Yayın Tarihi: 15-Mar-2025
Doi Referans: 10.1016/j.jcis.2025.137326
Resim Credits: LI Qingdong
Anahtar Kelimeler: biyobozunabilir nanoplatformlar kanser tedavisinde cuproptosis, kanser tedavisinde cuproptosis, nano-immün agonistler, kanser bağışıklık yanıtının artırılması, bağışıklık kontrol noktası inhibitörleri zorlukları, yenilikçi immünoterapi stratejileri, melanom immünosupresyon çözümleri, çok fonksiyonlu kanser terapötikleri, melanom tedavisinde nanoterapi, immünoterapide reaktif oksijen türleri, tümör biyolojik dokusunun yeniden programlanması, tümör mikroçevresi modülasyonu