Now Reading: SUMOileşmenin DNA Onarımı ve Radyoterapi Cevabındaki Rolü
-
01
SUMOileşmenin DNA Onarımı ve Radyoterapi Cevabındaki Rolü
SUMOileşmenin DNA Onarımı ve Radyoterapi Cevabındaki Rolü
Günümüzde kanser tedavisinde radyoterapi, tümör hücrelerinde çift zincirli DNA kırıkları oluşturarak etkisini gösteren en önemli yöntemlerden biridir. Ancak bazı tümörlerde DNA onarım mekanizmalarının aşırı aktif hale gelmesi, tedaviye direnç gelişmesine neden olmaktadır. Çin Bilimler Akademisi’ne bağlı Hefei Fizik Bilimleri Enstitüsü’nden Prof. ZHAO Guoping liderliğindeki araştırma ekibi, DNA hasar onarımını düzenleyen moleküler mekanizmaları ilk defa bu denli derinlemesine ortaya koyarak, kanser tedavisinde yeni ufuklar açtı. Özellikle, DNA onarım proteinlerinin işlevini şekillendiren post-translasyonel modifikasyonların karmaşık düzenleyici ağı ile ilgili önemli veriler sağlayan çalışma, kansere özgü radyo duyarlılığın artırılmasında kritik bir adım olarak değerlendiriliyor.
Radyoterapi esasen kanser hücrelerine hedeflerine kritik DNA hasarları, özellikle çift zincir kırıkları (DSB) vererek etkisini gösterir. Bu kırıklar, hücreler için hayati tehlike arz eden ve etkili şekilde onarılmazsa ölüme yol açan zararlardır. Fakat özellikle meme ve akciğer kanseri gibi bazı tümör tiplerinde DNA onarım proteinlerinin düzeyi anormal şekilde yüksektir. Bu da hasarın hızlı ve etkin düzeltilmesini sağlayarak, tümör hücrelerinin radyoterapia karşı direncini artırmaktadır. Araştırma ekibi, onarım sürecinin altında yatan karmaşık düzenin epigenetik ve post-translasyonel modifikasyonlarla şekillendiğini tespit etti. Bu bağlamda, SUMOylation adı verilen küçük ubiquitin-benzeri modifikasyon sürecinin DNA hasar onarımı üzerindeki etkisini kapsamlı şekilde incelediler.
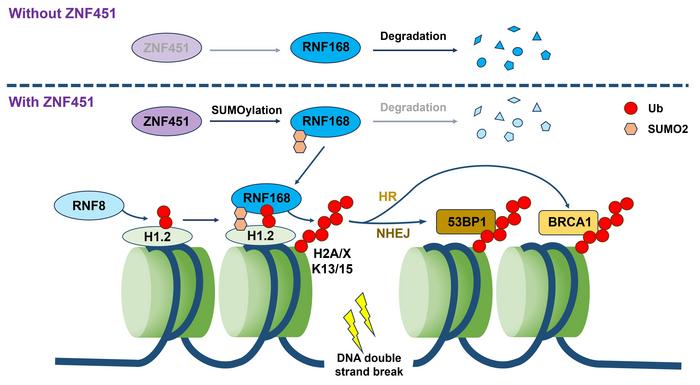
Araştırmanın merkezindeki önemli molekül ZNF451 adlı çinko parmak proteini oldu. ZNF451’in meme ve akciğer başta olmak üzere birçok malignitede belirgin şekilde aşırı eksprese edildiği saptandı. Klinik veriler, yüksek ZNF451 ekspresyonunun hastaların tedavi sonrası prognozunu olumsuz etkilediğini gösterdi. Radyasyon uygulandığında ZNF451, hızla DNA hasar bölgelerine yönelerek, önemli bir katalitik reaksiyonu tetikliyor ve RNF168 adlı ubiquitin ligazını SUMO2 ile modifiye ederek stabilitesini artırıyor. Bu SUMOyalasyon RNF168’in proteazomal yıkıma uğramasını engelleyerek, hasar bölgelerinde uzun süre kalmasını ve aktif formda bulunmasını sağlıyor.
RNF168, kromatindeki ubikitin sinyalini yayarak, özellikle histon H2A ve H2AX üzerinde işaretleme yapan kritik bir E3 ligazdır. Bu ubiquitin bağlanması, onarım kaskadını yöneten yardımcı proteinlerin hasar bölgesine toplanmasını kolaylaştırır. Böylece homolog rekombinasyon veya non-homolog sonlandırma gibi onarım yolları devreye girer. ZNF451’in RNF168 stabilitesini artırması, ubikitin sinyalini yükselterek DNA hasarının hızla onarılmasını sağlar. Bu mekanizma özellikle radyoterapinin başarısı için hayati önem taşır; çünkü tümör hücreleri, hasarı geciktirmeden ortadan kaldırdıklarında sağ kalma şanslarını yükseltirler.
Araştırmada ayrıca ZNF451 ve RNF8 adlı diğer önemli bir E3 ligaz arasında karmaşık bir etkileşim keşfedildi. Bu iki protein RNF168’in DNA hasar bölgesine bağlanmasını ve aktivitesini birbirlerine rekabetçi olarak engelliyor. Ancak her ikisi de eş zamanlı olarak yok edildiğinde, RNF168’in hasar alanlarına birikiminde ciddi azalma ortaya çıkıyor. Bu durum, ubiquitin sinyali için gereken optimal düzenlemenin zıt fakat tamamlayıcı etkilerle sağlandığını gösteriyor. Yani ZNF451 ve RNF8 arasında dinamik bir denge söz konusudur ve bu denge, DNA onarımı sırasında sinyalin şiddetini ve süresini ayarlıyor.
Bu bulgular ışığında araştırmacılar DNA hasar onarımı için yeni bir “dinamik denge düzenlemesi” modeli ortaya koydu. Model, birbirini karşılayan ligazların ubikitin sinyalini hassas şekilde kontrol ederek, hücrelerin etkili ve zamanında onarım yapmasına olanak tanıdığını belirtiyor. Tümör hücrelerinin bu mekanizmayı kullanarak radyoterapiye karşı direnç sağladığı düşünülmekte. Dolayısıyla bu dengeyi bozacak stratejiler geliştirmek, tedavi etkinliğini artırabilir ve radyo dirençli tümörlerin zayıflatılması için yeni hedefler sunabilir.
Araştırmanın ayrıca SUMOylation süreçlerinin DNA hasar yanıtındaki büyüyen önemini vurguladığını belirtmek gerekir. Ubiquitin modifikasyonları uzun süredir incelenirken, SUMO ile yapılan modifikasyonlar proteinlerin stabilitesi, konumu ve etkileşim ağlarını yeni bir boyutta düzenleyerek onarım mekanizmasına katılıyor. RNF168’in SUMO2 ile modifikasyonu, bu protein için kritik olan stabiliteyi sağlayarak onarım sürecinin etkinleşmesini sağlıyor. Bu da post-translasyonel modifikasyonlar arasındaki karmaşık ve ince ayarlanmış ilişkinin önemli bir kanıtıdır.
Prof. ZHAO ve ekibinin çalışması, ZNF451 ile RNF8-RNF168 arasında kurulan bu yeni düzenleme ekseninin hem moleküler mekanizmasını ortaya koyarken hem de bir klinik araç olarak kullanılmasının önünü açıyor. ZNF451’in SUMOylasyon aktivitesini engellemek veya RNF8 ile etkileşimini manipüle etmek, tümör hücrelerini radyoterapiye karşı daha hassas hale getirebilir. Bu yönde geliştirilecek farmakolojik ajanlar, kanser hastalarında tedavi başarısını ciddi anlamda artırabilir.
Öte yandan ZNF451 ekspresyonunun yüksek olması, olumsuz prognozla ilişkilendiriliyor ve bu durum biyobelirteç olarak kullanılabilir. Böylece hastalar moleküler profillerine göre sınıflandırılarak, daha agresif veya hedefe yönelik alternatif tedavi stratejileri uygulanabilir. Bu da kişiye özel tedavi yaklaşımlarının gelişmesine olanak sağlıyor. Kanser tedavi algoritmalarında bu yeni biyolojik hedefin dikkate alınması gelecekte önemli olumlu sonuçlar doğurabilir.
Sonuç olarak bu araştırma, ZNF451’in RNF168’in SUMOylasyonu aracılığıyla DNA onarım sinyalini artırması ve bunun RNF8 ile dinamik bir denge içinde gerçekleşmesi mekanizmasını ortaya koymuştur. Böylece DNA hasarlarına verilen hücresel yanıtın ne kadar hassas ve karmaşık bir şekilde kontrol edildiği ilk defa bu kadar net anlaşılmıştır. Kanserlerde bu dengenin bozulması, radyoterapiye karşı direnç oluşumunu açıklamada anahtar rol oynar. İleri dönemde, bu zıt etkileşimlerin kontrol altına alınması hem tedavi etkinliğini artırabilir hem de tedavi direncini önleyebilir.
Araştırmanın ortaya koyduğu mekanizmalar, kanser biyolojisi ve tedavisi alanında devrim niteliğinde bir ilerlemedir. Post-translasyonel modifikasyonların rolünü detaylandırırken, tümör DNA onarım mekanizmasındaki savunma yöntemlerinin açığa çıkarılmasında önemli katkı sağlar. Prof. ZHAO’nun ekibi sayesinde, DNA onarım düzenleyici ağlarının hassas kontrolü daha iyi anlaşılmış ve buna bağlı yeni tedavi yaklaşımlarının önü açılmıştır. Kanser hastalarında radyoterapiye duyarlılığın artırılması için bu bulgular büyük umut vadetmektedir.
Bu çalışma, kanser hücrelerinin DNA hasar yanıtını nasıl optimize ettiğini moleküler düzeyde çözümleyerek, tedaviye karşı direnç mekanizmalarının üstesinden gelmeyi hedefleyen bilimsel ve klinik araştırmalar için özgün bir temel oluşturuyor. Kanser tedavisinde DNA onarımı modifikasyonlarını hedefleyen yeni ilaçlar geliştirmek, bu dengenin işleyişini değiştirmek, hem klasik tedavilerin etkinliğini artıracak hem de hasta sağkalım oranlarını yükseltecektir. Böylece kanser biyolojisinde ve onkolojik terapilerde paradigma değiştiren bir alan açılmıştır.
Özetle, bu kapsamlı çalışma, ZNF451, RNF8 ve RNF168 proteinleri etrafında şekillenen SUMOylation ve ubiquitination ağının DNA onarımındaki kritik işlevini ortaya koymuştur. Kanserlerde mevcut tedavi dirençlerinin arkasındaki moleküler nedenleri açıklayan bu dengeleyici mekanizma, klinikte kullanılması halinde daha etkili ve kişiye özel radyoterapi protokollerinin geliştirilmesine olanak sağlayacaktır. Kanser tedavisinde DNA hasar onarımının hassas kontrolünü açığa çıkaran bu araştırma, önümüzdeki yıllarda onkoloji alanında çığır açacak gelişmelerin habercisidir.
**Araştırma Konusu**:
Regülasyon DNA hasar onarımı mekanizmaları; SUMOylation ve ubiquitination süreçlerinin rolü; ZNF451, RNF8 ve RNF168 proteinlerinin DNA tamiri ve radyo duyarlılık üzerindeki etkileri; kanser tedavisinde DNA onarım kapasitesinin modülasyonu.
**Makale Başlığı**:
ZNF451 collaborates with RNF8 to regulate RNF168 localization and amplify ubiquitination signaling to promote DNA damage repair and regulate radiosensitivity
**Haberin Yayın Tarihi**:
7-Mar-2025
**Web References**:
http://dx.doi.org/10.1038/s41418-025-01472-0
**Resim Credits**:
ZHAO Guoping
**Anahtar Kelimeler**:
kanser tedavisi gelişmeleri, çift zincir kırıkları, epigenetik DNA onarımı, Hefei Fizik Bilimleri Araştırması, kanser tedavi stratejileri, tümör hayatta kalma mekanizmaları, DNA hasar tamiri moleküler mekanizmaları, post-translasyonel modifikasyonlar, Profesör Zhao Guoping araştırma bulguları, radyoterapi etkinliği, SUMOylation ve DNA onarımı, tümörlerde radyoterapi direnci