Now Reading: AAV-CRISPR ile PD-L1 Hedeflenmesi: Over Kanseri Tedavisinde Yenilikçi Yaklaşım
-
01
AAV-CRISPR ile PD-L1 Hedeflenmesi: Over Kanseri Tedavisinde Yenilikçi Yaklaşım
AAV-CRISPR ile PD-L1 Hedeflenmesi: Over Kanseri Tedavisinde Yenilikçi Yaklaşım
Ovarian kanser tedavisinde çığır açan bir gelişme olarak, araştırmacılar, tümör hücrelerinde doğrudan PD-L1 ifadesini hedefleyip yok etmeye yönelik adeno-associated virus (AAV) vektörleri ile CRISPR/Cas9 gen düzenleme teknolojisini birleştiren yenilikçi bir gen immünoterapi stratejisi geliştirdi. Geleneksel antikor tedavilerinin immune checkpoint moleküllerini hedeflemesinde yaşanan yanıt oranı sınırlılıkları dikkate alındığında, bu tedavi yaklaşımı özellikle dirençli ve tedavisi zor olan over malignitelerinde umut verici bir alternatif oluşturuyor. Over kanseri microçevresindeki immünosupresif ortam, bağışıklık sistemi tepkilerini baskılayarak klasik immün kontrol noktası inhibitörlerinin etkinliğini azaltmaktadır. Bu bağlamda, tümör hücrelerinde sıkça aşırı ekspresyon gösteren ve T hücrelerinin fonksiyonel tükenmesine neden olan PD-L1 molekülünün genom düzeyinde kalıcı olarak ortadan kaldırılması, tedaviye tamamen farklı bir bakış açısı kazandırıyor.
Araştırma ekibi, AAV vektör sistemi kullanarak, CRISPR/Cas9 bileşenlerini ovarian kanser hücrelerindeki PD-L1 geni üzerine spesifik olarak hedefleyen bir yapı tasarladı. AAV vektörlerinin tercih edilmesi; klinik deneylerde kanıtlanmış güvenlik profili, düşük immünojenite ve vücut içinde yüksek enflamasyon yaratmadan etkin hedef hücrelere ulaşma kapasitesi gibi avantajlara dayanıyor. Böylece, antikor tedavilerinde sıkça karşılaşılan geçici etkiler ve sistemik toksisite gibi dezavantajlar büyük ölçüde ortadan kaldırılıyor. Bu yaklaşım, PD-L1 ifadesini kalıcı olarak susturarak, anti-tümör bağışıklık yanıtlarının tam anlamıyla yeniden canlanmasını amaçlıyor.
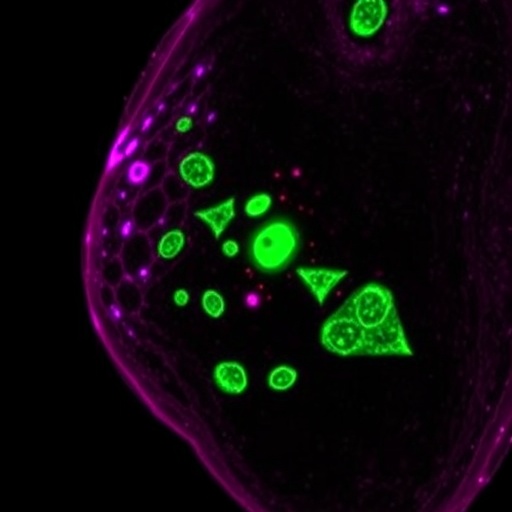
Deneysel aşamada, PD-L1 hedefli AAV partikülleri oluşturuldu ve bunlar fare kökenli ID8 adlı over kanseri hücre hattına aktarıldı. Tedavi sonrası yapılan analizlerde, PD-L1 seviyelerinde kontrol grubuna kıyasla belirgin ve istatistiksel olarak anlamlı bir azalma gözlendi. Bu sonuç, gen düzenleme stratejisinin hücre düzeyinde etkin bir PD-L1 gen kesintisi sağladığını net biçimde ortaya koydu ve tedavi yaklaşımının konsept olarak geçerliliğini doğruladı. Böylece, hastalıkla mücadelede kullanılan diğer yöntemlerden farklı, genomik bazlı bir hedef müdahale modeli oluşturuldu.
Araştırmanın in vivo aşamasında ise peritonel dağılım modeli kullanıldı; bu model over kanserinin metastatik yayılımını ve karın içi tutulumunu klinikte olduğu gibi yansıtması nedeniyle tercih edildi. Bu modelde, PD-L1 hedefli AAV partiküllerinin intraperitoneal enjeksiyonu yapılan farelerde sağkalım süresi kontrol gruplarına göre anlamlı şekilde uzadı. Bu da, PD-L1 geninin sistematik olarak devre dışı bırakılmasının tümör ilerlemesini baskılayıcı, konakçı bağışıklık sistemi fonksiyonlarını ise destekleyici bir etki yarattığını gösterdi. Böylelikle, deneysel ortamdan klinik benzerine başarılı geçiş sağlandı.
Tümör mikroçevresinde gerçekleşen immünolojik değişimler immünohistokimyasal analizlerle ortaya kondu. Tedavi edilen gruplarda, tümör bölgelerinde belirgin şekilde artan CD4+ yardımcı T hücreleri ve CD8+ sitotoksik T lenfosit infiltrasyonu gözlemlendi. Bu durum, anti-tümör bağışıklık sisteminin yeniden aktive olduğuna işaret etti. Aynı zamanda, Foxp3+ düzenleyici T hücrelerinin sayısında azalma tespit edilirken, bu da immünosupresif baskının hafifleyerek tümör karşıtı yanıtların artırıldığını göstermekteydi. Tüm bu değişiklikler, tümör ortamının daha immünojenik ve bağışıklık saldırısına açık hale geldiğini net biçimde ortaya koydu.
Tedavinin güvenilirliği dikkatli şekilde değerlendirildi; karaciğer, akciğer, dalak ve böbrek gibi başlıca organların histolojik incelemelerinde önemli bir toksik etki ya da hedef dışı dokularda hasar kaydedilmedi. Bu veriler, AAV-CRISPR tabanlı gen düzenleme yaklaşımının hem etkin hem de güvenli olduğunu ve sistemik yan etkiler açısından geleneksel kemoterapi veya antikor tedavilerinin önünde bulunduğunu gösterdi. Hedefe özgü gen etkileşimi, tedavinin klinik uygulamalarda sürdürülebilirliğini artıran önemli bir avantaj olarak ortaya çıktı.
Bu çalışma, viral vektörlerin genom düzenleme araçlarıyla birleştirilerek ovarian kanserde immünoterapi direncinin üstesinden gelmede devrimci bir metodu temsil ediyor. CRISPR/Cas9’un yüksek özgüllük ve kalıcılığı sayesinde, immünosupresif mekanizmaların moleküler kökenleri bloke edilerek, tümörün bağışıklık sisteminin saldırısından kaçış stratejisi etkili bir şekilde bozuluyor. Böylece, hastaların kendi bağışıklık sistemleri kalıcı olarak harekete geçirilerek, kanserle mücadelede yeni bir sayfa açılıyor.
AAV vektörlerinin kullanımı, klinik ölçeklenebilirlik açısından büyük önem taşıyor. Daha önce farklı hastalıklar için yapılan gen terapi denemeleri sayesinde AAV’lerin güvenilirliği ve uzun süreli gen ekspresyonu ortaya konmuş durumda. Bu özellikler, kanser immünoterapisinde kalıcı etkinliğin sağlanması açısından kritik. Ayrıca, tek doz gen tedavilerinin uygulama kolaylığı, hasta konforunu artırmakta, tedaviye uyum ve maliyet etkinliğini yükseltmekte. Böylece, tekrar tekrar antikor enjeksiyonu gerekliliğini ortadan kaldırarak tedavinin sürdürülebilirliği anlamlı ölçüde iyileştirilmekte.
Tedavi sonrası gözlemlenen artan etkinlenmiş T hücre infiltrasyonu ile azalan düzenleyici T hücre popülasyonları, tümör mikroçevresinin yeniden programlandığını ve bağışıklık temelli saldırıya daha açık hale geldiğini gösteriyor. Bu potansiyel durum, bu gen düzenleme yöntemi ile birlikte immün aşılar veya küçük molekül immün modülatörleri gibi diğer tedavi yöntemlerinin kombinasyonunu mümkün kılarak, kompleks kanser tedavilerinde sinerjistik etki yaratmaya olanak sağlıyor. Böylelikle dirençli tümörlerde bile daha kapsamlı klinik yanıtlar elde edilebilir.
Gelecekte, CRISPR/Cas9 teknolojisinin klinik kullanımdaki uzun dönem genomik stabilitesi, genetik hedef dışı etkileri (off-target) ve beklenmeyen immünolojik durumların detaylı değerlendirilmesi kritik öneme sahip olacak. Mevcut bulgular, preklinik aşamadan klinik uygulamaya geçiş için sağlam bir platform sağlarken, güvenlik ve etkinlik optimize edilerek over kanserinde özellikle tedaviye dirençli vakalar için yeni standartlar oluşturulabilir. Böylece, zorlu malignitelerde kişiselleştirilmiş gen tabanlı immünoterapi dönemi başlayabilir.
Geniş perspektifte bakıldığında, bu araştırma, immünolojik engelleyici yolların kesin ve hedefe özgü genetik olarak in vivo devre dışı bırakıldığı bir tedavi paradigmasının habercisi niteliğinde. Protein bazlı inhibitörlerin dezavantajlarını aşan bu yaklaşım, moleküler tıpta bireyselleştirilmiş ve kalıcı çözümler sunuyor. Kanser immünoterapisinin evrimi için çığır açan bu yenilikçi teknoloji, sadece ovarian kanser değil, çok sayıda yüksek PD-L1 ekspresyonlu ve checkpoint inhibitörlerine dirençli solid tümör tipinde de uygulanabilir potansiyel taşıyor.
Sonuç olarak, AAV-CRISPR/Cas9 aracılığıyla PD-L1 geninin ortadan kaldırılması, ovarian kanser tedavisinde önemli bir sıçrama yaratıyor. Bağışıklık sisteminin tümörü tanıması ve tahrip etme kabiliyetini moleküler düzeyde artıran bu yöntem, hasta sağkalım oranlarını yükseltirken tedavi standartlarını da dönüştürme potansiyeline sahip. Kişiye özgü immünogenetik müdahalelerle kanseri yönetilebilir bir hastalığa dönüştürme hedefi, bu teknoloji ile her geçen gün daha ulaşılabilir hale geliyor.
—
Araştırma Konusu: Over kanseri gen immünoterapisi; PD-L1 hedefi; AAV-CRISPR/Cas9 gen düzenleme teknolojisi
Makale Başlığı: Adeno-associated virus-clustered regularly interspaced short palindromic repeats/cas9‑mediated ovarian cancer treatment targeting PD-L1
Web References: https://doi.org/10.1186/s12885-025-14093-0
Doi Referans: https://doi.org/10.1186/s12885-025-14093-0
Resim Credits: Scienmag.com
Anahtar Kelimeler: AAV gene therapy for ovarian cancer, adeno-associated virus delivery system, cancer immunotherapy advancements, CRISPR/Cas9 PD-L1 targeting, enhancing anti-tumor immune response, gene editing in cancer treatment, immune checkpoint inhibition in ovarian cancer, innovative treatments for resistant cancers, novel immunotherapy for ovarian malignancies, overcoming immunosuppressive tumor microenvironment, PD-L1 knockout strategy, precision medicine in oncology