Now Reading: Lipid Metabolizmasının Meme Kanseri İlerlemesi ve Tedavi Direncine Etkileri
-
01
Lipid Metabolizmasının Meme Kanseri İlerlemesi ve Tedavi Direncine Etkileri
Lipid Metabolizmasının Meme Kanseri İlerlemesi ve Tedavi Direncine Etkileri
Son yıllarda kanser biyolojisi alanında yapılan çalışmalar, meme kanseri hücrelerinin malign özelliklerini sürdürebilmeleri için uyguladıkları karmaşık metabolik adaptasyonları derinlemesine anlamamıza olanak tanımıştır. Bu metabolik uyumlar arasında lipid metabolizmasındaki değişiklikler, tümör büyümesi, metastaz ve tedaviye yanıtlar üzerinde kritik etkiler göstererek öne çıkmaktadır. Özellikle triple-negatif meme kanseri (TNBC) gibi agresif alt tiplerde lipid yolaklarının yeniden programlanması, hastalığın ilerlemesi ve direnç mekanizmalarının gelişmesinde belirleyici rol oynamaktadır. Kanser hücrelerinin lipid metabolizmasındaki bu ince düzenlemeleri daha iyi kavramak; hastalıkla mücadelede yeni tedavi stratejilerinin geliştirilmesine kapı aralamaktadır.
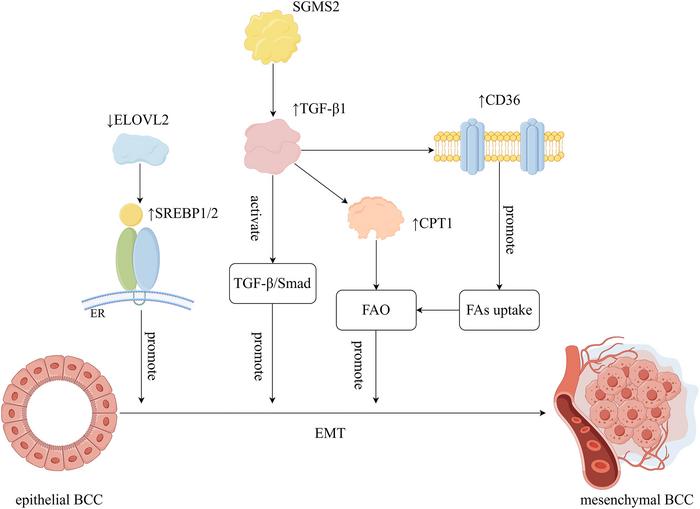
Meme kanserinde lipid metabolizmasındaki en belirgin değişikliklerden biri, yağ asitlerinin artan alımı ve de novo sentezidir. Hızla çoğalan kanser hücreleri için sadece enerji gereksinimi değil, aynı zamanda hücre membranlarının yapımı ve hücre içi sinyalizasyonların devamlılığı için temel lipid yapılar gerekmektedir. Bu kapsamda, yağ asidi sentezi enzimi olan Fatty Acid Synthase (FASN) ile yağ asidi taşınmasından sorumlu CD36 ve Fatty Acid-Binding Protein 4 (FABP4) gibi proteinler tümör hücrelerinde önemli ölçüde yükselmiştir. Bu artış, tümör içi lipid birikimini tetikleyerek hücre membranlarının yeniden şekillenmesini sağlar; bu da hücrelerin hareket kabiliyetini ve invazivlik yeteneklerini artırarak metastaz potansiyelini güçlendirir.
Kolesterol metabolizması, meme kanseri patogenezinde başka bir önemli ekseni temsil etmektedir. Kolesterol biyosentezindeki artışa paralel olarak, 27-hidroksikolesterol (27HC) adlı kolesterol metaboliti tümör progresyonunda aktif rol oynamaktadır. 27HC, hem östrojen reseptörlerini aktive eden bir ligand olarak işlev görür hem de tümör mikroçevresindeki bağışıklık hücrelerinin davranışlarını düzenleyerek kanserin bağışıklık sisteminden kaçışını sağlar. Kolesterol metabolizmasının temel düzenleyicilerinden SREBP2, NSDHL ve STARD4 proteinleri sıklıkla dengesizleşirken, bu durum malign fenotipleri destekleyip tümör hücrelerinin bağışıklık kontrol noktalarını ve inflamatuar yanıtlarını yeniden şekillendirerek immün evazyonu kolaylaştırır.
Sfingolipid metabolik ağı ise meme kanseri biyolojisinde ilginç bir çelişki sergilemektedir. Ceramid birikimi, apoptotik süreci destekleyerek tümör bastırıcı etki yaratırken, glikozile olmuş sfingolipid türevleri (örneğin Globo-H ceramid ve GD2) ise tümör oluşumu, anjiyogenez ve kanser kök hücrelerinin korunmasında rol alır. Bu iki zıt fonksiyon, lipid aracılı sinyal yollarının ne denli karmaşık ve hücre kaderini belirlemede etkili olduğunu ortaya koymaktadır.
Lipid metabolizmasının yeniden programlanmasının en zararlı etkilerinden biri, epitelden mezenşimal geçiş (EMT) sürecini kolaylaştırmasıdır. EMT, kanser hücrelerine artan göç yeteneği ve apoptozdan direnç kazandırırken; bu süreçte yağ asidi elongazı ELOVL2, sfingomiyelin sentaz 2 (SGMS2) ve kemokin CXCL8 gibi moleküler düzenleyiciler rol oynar. Bu faktörler, TGF-β, PI3K/AKT ve sterol düzenleyici element bağlayıcı proteinler (SREBP’ler) aracılığıyla karmaşık sinyal ağlarını yöneterek hücre gene ekspresyonunu mezenşimal ve invaziv bir fenotipe kaydırır.
Tümör bağışıklık mikro ortamı (TIME) ise lipid sinyallerine karşı pasif kalmayıp dinamik olarak uyum sağlar. İmmünsüpresif M2 makrofajlar ve kanser ilişkili fibroblastlar (CAF’lar), lipid metabolizmalarını değiştirerek sitokin profillerini ve ekstraselüler matriks bileşenlerini yeniden şekillendirir ve böylece tümör ilerlemesini destekler. Aynı zamanda, sitotoksik CD8+ T hücreleri lipid aracı mekanizmalarla fonksiyonel bozulmaya uğrayarak anti-tümör bağışıklığı zayıflatır; bu da tümörün bağışıklık sisteminden kaçışını kolaylaştıran önemli bir adımdır.
Klasik meme kanseri tedavilerine direnç gelişimi, lipid metabolizmasının köklü yeniden programlanmasıyla yakından ilişkilidir. Kanser hücreleri, CD36 gibi lipid taşıyıcıların ve FASN gibi lipid sentez enzimlerinin yanı sıra mitokondriyal yağ asidi oksidasyon bileşeni CPT1’in ekspresyonunu artırarak apoptoz sinyallerinden kaçınır ve ilaç birikimini azaltır. G protein-bağlı reseptör 120 (GPR120) ise pro-survival lipid sinyalini görevlendirerek kanser kök hücrelerinin korunmasına ve tedavi direncine katkıda bulunur.
Lipid metabolizmasıyla onkojenik sinyal yolakları arasındaki çapraz iletişim, meme kanserinin biyolojik karmaşıklığını artırmaktadır. SREBP1/2 transkripsiyon faktörleri, lipid biyosentezi ve alımıyla ilgili genleri düzenlerken; TGF-β ve PI3K/AKT yollarıyla etkileşime girerek malign davranışları destekler. ELOVL2’nin aşağı regülasyonu ise lipid dengesini bozarak EMT ve metastatik yayılımı teşvik eder. Böylece metabolik enzimler ile hücresel fenotip plastisitesi arasında sıkı bir ilişki ortaya çıkar.
Kolesterol metabolitlerinin rolü sadece tümör hücrelerine özgü değildir; 27HC yerel immünsüpresif etkileri sayesinde tümör-infiltrasyon yapan lenfositleri etkileyerek bağışıklık gözetiminden kaçışa zemin hazırlar. Bu ‘ikili’ görev, özellikle hormon reseptör pozitif meme kanserlerinde östrojen sinyalizasyonuyla lipid metabolizması arasında etkileşim gerektiren karmaşık terapötik zorluklar doğurur.
Lipid metabolizmasını hedef alan yeni terapötik girişimler, tedavi direncini aşma potansiyeli taşımaktadır. FASN inhibitörleri, CD36 aracılı yağ asidi alımını engelleyen blokörler ve sfingolipid yollarını modüle eden ilaçlar, mevcut tedavilere duyarlılığı artırmaya yönelik umut vadeden ajanlardır. Lipid metabolizmasını geleneksel veya immün bazlı tedavilerle kombine etmek, daha kalıcı yanıtlar için yeni bir strateji sunmaktadır.
Bu yaklaşımlar, meme kanserinde özellikle TNBC gibi agresif alt tiplerde lipid metabolizmasının temel bir etken olduğunu yeniden teyit ederken; moleküler temellerin ayrıntılı çözümlemesi sayesinde yeni biyobelirteçlerin keşfi ve metabolizma hedefli tedavilerin geliştirilmesi mümkün olacaktır. Böylece etkinliği artırılmış, daha kişiselleştirilmiş tedavi seçenekleri hastaların yaşam kalitesini ve genel sağkalım oranını iyileştirebilir.
Araştırmalar ilerledikçe, lipidomik verilerin genomik ve proteomik bilgilerle birleştirilmesi, meme kanserinin metabolik zayıflıklarının belirlenmesinde kritik öneme sahip olacaktır. Çok disiplinli çalışmalar, mekanistik keşiflerin klinik uygulamalara dönüşmesini sağlayarak, onkolojide kişiye özel tedavi paradigmasını güçlendirmektedir. Bu bütüncül strateji, özellikle tedaviye dirençli meme kanseri vakalarında yeni umut kapıları açmaktadır.
Sonuç olarak, lipid metabolizmasının yeniden programlanması, meme kanserinin ilerlemesi, metastazı, bağışıklık sisteminden kaçışı ve tedavi direncini belirleyen temel bir eksen olarak ortaya çıkmaktadır. Bu metabolik cepheyi derinlemesine anlamak ve hedeflemek, kanser tedavisinde devrim yaratacak yeni stratejileri mümkün kılacaktır. Meme kanseri hastalarına daha uzun ve kaliteli yaşam sağlamak adına lipid metabolizmasına yönelik araştırmalar hızla önem kazanmaktadır.
—
**Araştırma Konusu**: Lipid metabolizmasının meme kanseri progresyonu ve tedavi direncindeki rolü, özellikle triple-negatif meme kanserindeki metabolik yeniden programlanma mekanizmaları.
**Makale Başlığı**: Lipid metabolism involved in progression and drug resistance of breast cancer.
**Web References**: http://dx.doi.org/10.1016/j.gendis.2024.101376
**Doi Referans**: 10.1016/j.gendis.2024.101376
**Resim Credits**: Genes & Diseases
**Anahtar Kelimeler**: Meme kanseri, lipid metabolizması, yağ asitleri, kolesterol, sfingolipidler, epitel-mezenşimal geçiş (EMT), ilaç direnci, tümör mikroçevresi, triple-negatif meme kanseri, FASN, CD36, 27-hidroksikolesterol