Now Reading: Hücre Hareket Desenleriyle Sağlıklı ve Kanserli Hücrelerin Ayırt Edilmesi
-
01
Hücre Hareket Desenleriyle Sağlıklı ve Kanserli Hücrelerin Ayırt Edilmesi
Hücre Hareket Desenleriyle Sağlıklı ve Kanserli Hücrelerin Ayırt Edilmesi
Kanser ve sağlıklı hücrelerin ayrımında çığır açan bir teknoloji Tokyo Metropolitan Üniversitesi’nden geldi. Araştırmacılar, floresan işaretleme gerektirmeden, hücrelerin doğal hareketlerini takip ederek kanserli hücrelerle sağlıklı hücreleri ayırt etmenin yepyeni bir yolunu keşfettiler. Faz-kontrast mikroskopisi adı verilen etiket gerektirmeyen bu görüntüleme tekniği kullanılarak, kültür ortamında bulunan malign fibrosarkom hücreleri ile sağlıklı fibroblastlar arasındaki farklı hareket paterni gözlemlendi. Araştırmanın titiz analizleri, hücrelerin izlediği yolların şekil ve kıvrım farklılıklarının, bu iki hücre tipini %94 doğrulukla ayırt etmek için güvenilir göstergeler olduğunu ortaya koydu.
Geleneksel olarak, mikroskop altında hücre analizleri statik özelliklerin incelenmesiyle sınırlı kaldı. Morfolojik yapı, hücre içi bileşim ve çeşitli boyama yöntemleriyle saptanan moleküler işaretleyiciler, hücrelerin durgun anlarını yansıttı. Ancak bu yöntemler, yaşam halindeki hücrelerin dinamik doğasını göz ardı ediyor. Canlı hücreler, hem içsel genetik programları hem de dışsal uyarılar doğrultusunda sürekli hareket etmekte ve şekil değiştirmektedir. Tokyo Metropolitan Üniversitesi’nin çalışması, özellikle kanserin metastaz sürecine katkıda bulunan hücre göçü kalıplarının biyolojik önemini vurgulayarak bu hareketlerle tanı koyma imkanlarını araştırdı.
Hücre hareketlerinin zamana bağlı olarak hassas takibi geçmişte önemli zorluklar barındırıyordu. Yalnızca birkaç hücrenin manuel gözlemi taraflı sonuçlara yol açabilirken, otomatik sistemlerin çoğu hücreleri görünür kılmak için floresan etiketlere ihtiyaç duyuyordu. Oysa floresan boyalar, hücrelerin biyolojik özelliklerini değiştirebilir, deney sonuçlarını etkileyebilir ve klinik uygulamalar için uygunluğunu azaltabilirdi. Bu yüzden, bireylerin gerçek fizyolojik şartlarına zarar vermeden, etiket kullanmadan yüksek verimli ve otomatik hücre göçü takip sistemleri geliştirmek önemli bir hedef oldu.
Prof. Hiromi Miyoshi liderliğindeki Tokyo Metropolitan Üniversitesi araştırma grubu, bu hedefe faz-kontrast mikroskopisi kullanarak ulaştı. Faz-kontrast mikroskopisi, şeffaf numunelerde işaretleyiciye ihtiyaç duymadan görüntü veren optik bir yöntem. Hücre ile ortamının farklı kırılma indisi değerlerini kullanarak hücreleri net şekilde ortaya çıkarıyor. Bu teknik, standart kültür kaplarından kaynaklanan optik bozunmaları ortadan kaldırarak hücrelerin hareketleri üzerinde herhangi bir müdahale olmadan gerçek zamanlı gözlem yapılmasına olanak tanıdı.
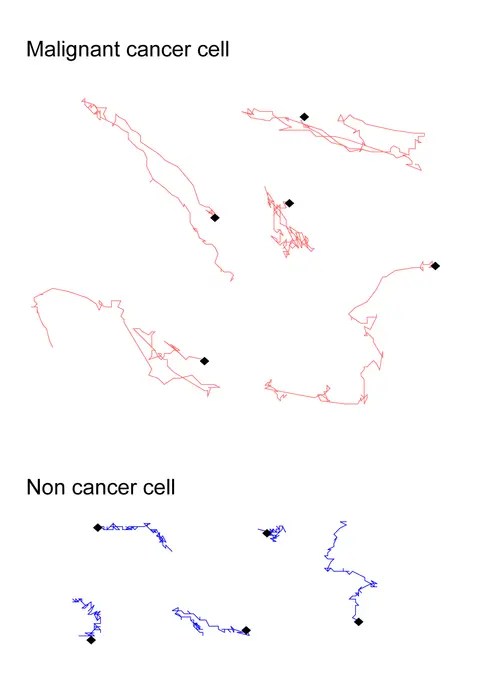
Araştırmacılar, zaman serisi faz-kontrast videolarından otomatik görüntü analiz algoritmalarıyla tek tek hücrelerin göç yollarını çıkardı ve yeniden yapılandırdı. Hücrelerin izlediği patikalara yönelik göç hızı ve “dönüş açıları toplamı” gibi metriklerle hareketler sayısallaştırıldı. Özellikle hücrelerin yön değiştirme sıklığı ve yolun kıvrımlılığı, kanser ve sağlıklı hücreler arasındaki mekanik ve morfolojik farkları kodlayan hayati parametreler olarak belirlendi.
Malign fibrosarkom hücreleri ile sağlıklı fibroblastlar arasındaki karşılaştırma, yöntemin tanısal potansiyelini net biçimde ortaya koydu. Her iki hücre tipi mikroskopta benzer görünsede, göç yolları ayırt edici özellikler taşıyordu. Sağlıklı fibroblast hücreler, daha yavaş ve düz hatlarda hareket ederken, kanser hücreleri daha düzensiz, kıvrımlı ve inişli çıkışlı rotalar izliyordu. Bu hassas farklılıkların tanımlanması, hücre tiplerinin %94 doğrulukla sınıflandırılmasını sağladı.
Bu teknolojinin kanser hücre ayrımının ötesinde geniş etkileri bulunuyor. Hücre göçü; embriyogenez, bağışıklık yanıtları, doku yenilenmesi ve metastatik ilerleme gibi birçok fizyolojik ve patolojik süreci şekillendiriyor. Etiket gerektirmeyen ve sayısal göç izleme yöntemi, bu biyolojik mekanizmaların araştırılmasına yeni kapılar açabilir. Hücre analizinin durağan görüntülerden dinamik göç yollarına kaydırılması, hem temel hücre biyolojisini hem de sağlık ve hastalık durumundaki hücre davranışlarını çok daha derinlemesine anlamamıza imkan tanıyacak.
Teknolojinin otomatik ve etiket kullanmayan yapısı klinik uygulamalar için ayrıca büyük avantaj sunuyor. Floresan veya kimyasal işaretleyici gerektirmemesi maliyet, zaman ve hücre zararını azaltıyor. Böylece, hasta kökenli hücrelerin gerçek zamanlı takibi pratikleşiyor. Kişiye özgü tedavi süreçlerinde, biyopsi örneklerindeki malign hücrelerin hızlı tanımlanması, tanısal doğruluğu artırarak tedavi yönlendirmesine katkı sağlıyor.
Yöntem, kanser prognozunda iyileştirme vaat ediyor. Metastaz, kanserlerin en ölümcül özelliği olduğundan, hareket paternlerindeki ince farkların yakalanması tümör agresifliğinin ve yayılma olasılığının öngörülmesini mümkün kılabilir. Böylece erken müdahale yapılarak hastaların yaşam kalitesi ve süresi artırılabilir. Ayrıca, bu sayısal göç izleme platformu, anti-metastatik etkisi olan aday ilaçların hücre hareketlerine etkilerini gerçek zamanlı gözlemlemek için güçlü bir araç haline geliyor.
Teknik açıdan, çalışmanın başarısı ileri mikroskopi teknikleri ile bilgisayarlı görüntü analizinin bütünleşmesine dayanıyor. Faz-kontrast görüntülerden otomatik olarak hücre yollarının çıkarılması, gürültünün azaltılması, kesin hücre segmentasyonu ve uzun süreli zorluklara rağmen doğru izleme algoritmaları gerektirdi. Hücrelerin kalabalıklaşması, üst üste binmesi ve şekil değişiklikleri gibi sorunlar bu algoritmalar tarafından başarıyla aşılmış ve büyük veri kümeleri insani müdahale olmadan işlenebildi.
Bu yöntem, hücrelerin doğal davranışlarına sadık kalınıp işaretleyicilerin neden olduğu olası hareket bozukluklarından kaçınarak biyolojik açıdan yüksek geçerlilik sağlıyor. Geleneksel floresan teknikleri genetik veya kimyasal değişiklik gerektirdiği için hücre metabolizması, iskelet yapısı ve sinyal mekanizmalarını etkileyebilir, böylece gözlemlenen davranışları yanıltabilir. Hücrelerin neredeyse fizyolojik koşullardaki izlenmesi, elde edilen bulguların klinik geçerliliği açısından çok değerlidir.
Ayrıca, bu araştırmanın bir diğer önemli bulgusu, hücre göçünün toplu analizinin tanıdaki başarısını artırmasıdır. Otomatik sistemler aynı anda yüzlerce hatta binlerce hücrenin hareketini takip ederek örneklem yanlılığını en aza indiriyor ve sağlıklı-kanser hücresi ayrımında istatistiksel güvenilirliği yükseltiyor. Yüksek verimli bu yöntem, veri elde etmeyi hızlandırarak klinik ortamda zamanında sonuç almayı mümkün kılıyor.
Dünya genelinde kanser biyolojisi alanındaki karmaşıklıklar çözüldükçe, hücrelerin fiziksel ve dinamik özelliklerini kullanan araçlar, moleküler ve genetik analizleri tamamlayıcı nitelikte ön plana çıkıyor. Tokyo Metropolitan Üniversitesi araştırma ekibinin geliştirdiği bu yenilikçi yöntem, klasik mikroskopiyi modern hesaplamalı analizlerle birleştirerek biyomedikal açıdan uygulanabilir bulgular sağlıyor.
Sonuç olarak; faz-kontrast mikroskopiyle elde edilen hücre göç profillerinin incelenmesi yoluyla, etiket gerektirmeyen ve invazif olmayan kanser hücresi tanımlama alanında önemli bir ilerleme sağlandı. Malign fibrosarkoma hücreleri ile sağlıklı fibroblastların %94 doğrulukla ayırt edilmesi, tanı, ilaç geliştirme ve temel hücre biyolojisi alanlarında yeni ufuklar açıyor. Bu teknolojinin daha da geliştirildiği ve klinik doğrulamalardan geçirildiği süreçte, hem laboratuvarlarda hem de tıbbi uygulamalarda kanserle mücadele ve hücre davranışlarının anlaşılması konusunda vazgeçilmez bir araç haline gelmesi bekleniyor.
—
Araştırma Konusu:
Hücre hareketine dayalı label-free faz-kontrast mikroskopisi ile kanserli ve sağlıklı hücrelerin ayrımı
Makale Başlığı:
Development of label-free cell tracking for discrimination of the heterogeneous mesenchymal migration
Haberin Yayın Tarihi:
31 Mart 2025
Web References:
http://dx.doi.org/10.1371/journal.pone.0320287
Resim Credits:
Tokyo Metropolitan University
Anahtar Kelimeler:
Kanser araştırması, Hücre göçü, Kanser hücreleri, Görüntü analizi, Fibroblastlar, Metastaz, Hız, Hücre polaritesi