Now Reading: Solid Tümörlerin Tanı ve Tedavisinde Yeni Radyolabel Antikor Geliştirildi
-
01
Solid Tümörlerin Tanı ve Tedavisinde Yeni Radyolabel Antikor Geliştirildi
Solid Tümörlerin Tanı ve Tedavisinde Yeni Radyolabel Antikor Geliştirildi
Kanser tedavisinde ve tanısında yeni bir dönemin kapıları aralanıyor. Son dönemde The Journal of Nuclear Medicine dergisinin Nisan sayısında yayımlanan çığır açıcı bir çalışma, kanserle mücadelede kullanılan moleküler hedeflere odaklanarak, IL13Rα2 antijenini yüksek özgüllükle tanıyan yeni bir radyo-boyalı antikorun geliştirilmesini duyurdu. KLG-3 olarak adlandırılan bu yenilikçi antikor, özellikle IL13Rα2 ekspresyonuna sahip tümör hücrelerini seçici olarak hedef alırken, sağlıklı dokularda yaygın olarak bulunan IL13Rα1 reseptörünü etkilemiyor. Bu üstün seçimlik özelliği sayesinde, hem moleküler görüntülemenin doğruluğu artacak hem de radyoterapide yan etkilerin minimize edilmesi mümkün olacak.
IL13Rα2, uzun süredir agresif katı tümörlerde, özellikle glioblastoma, melanom ve üçlü negatif meme kanseri gibi kanser türlerinde aşırı ekspresyon gösteren önemli bir biyobelirteç olarak kabul ediliyor. Buna karşılık IL13Rα1, vücutta geniş bir alanda normal hücrelerde bulunan bir reseptör olduğundan, hedeflenen tedavilerde doğruluk ve güvenlik açısından dezavantaj oluşturuyor. Bu nedenle, IL13Rα2 özelinde geliştirilen tanı ve tedavi yöntemleri, kanser hücrelerini seçici olarak hedefleyip sağlıklı dokulara zarar vermeden terapi uygulamak açısından büyük önem taşıyor. Şimdiye kadar IL13Rα2’ye yönelik antikor bazlı klinik uygulamalar geliştirilememişti, ancak bu araştırma bu kritik boşluğu doldurmayı amaçlıyor.
Araştırmanın başında bulunan Dr. Simone Krebs öncülüğünde, Memorial Sloan Kettering Cancer Center, Tri-Institutional Therapeutics Discovery Institute ve University of Texas MD Anderson Cancer Center’dan multidisipliner bir ekip, IL13Rα2’ye özgü beş yeni insan antikoru (KLG-1’den KLG-5’e kadar) geliştirdi. Bu antikorlar, laboratuvar ortamında bağlanma afinitesi, özgüllük ve IL13Rα1’e karşı çapraz reaksiyon açısından kapsamlı testlerden geçirildi. Sonuçlar, KLG-3’ün hem üstün bağlanma kinetiği hem de yüksek seçicilik sağlayan başlıca aday olduğunu gösterdi. Özgüllüğün artırılması, yalancı pozitif sonuçların önüne geçilmesinde ve yan dokulara gereksiz ışın verilmesinin önlenmesinde büyük rol oynuyor.
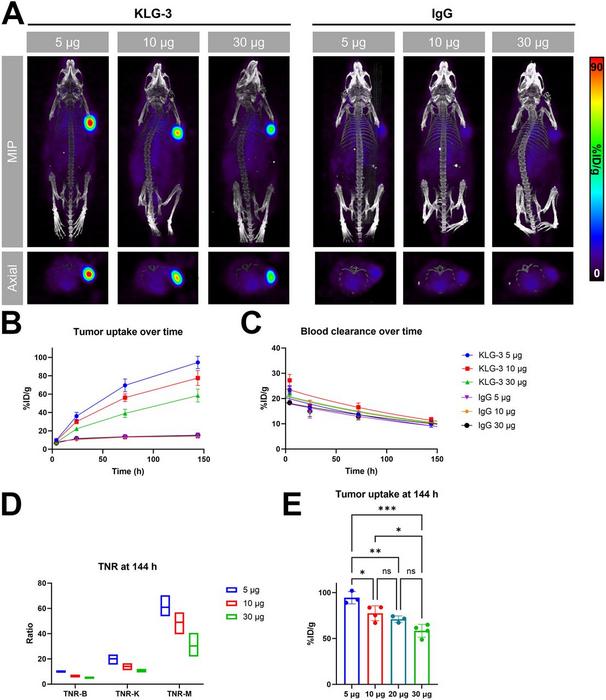
İn vivo çalışmalar kapsamında, KLG-3 antikorunun zironyum-89 (^89Zr) radyoizotopuyla işaretlenmiş halinin glioblastoma xenograft fare modellerinde immuno-PET (pozitron emisyon tomografisi) görüntülemesinde kullanılması sağlandı. Enjeksiyondan 144 saat sonra çekilen yüksek çözünürlüklü PET/BT görüntüleri, tümör dokusunda dikkat çekici boyutta radyoaktif birikme gösterirken, sağlıklı organlarda düşük arka plan sinyali gözlendi. Yüksek tümör-doku oranı, KLG-3’ün tümör sınırlarını kesin şekilde belirleyebilme ve tedavi etkinliğini gerçek zamanlı izleyebilme kapasitesini ortaya koydu. Bu özellik, geleneksel görüntüleme ajanlarına göre önemli bir avantaj sunuyor.
Klinik uygulamaya geçişi kolaylaştırmak adına gerçekleştirilen doz titrasyon çalışmaları, düşük antikor dozlarının dahi güçlü sinyal alımı sağladığını gösterdi. Bu durum, sistemik antikor maruziyetini azaltarak hasta güvenliğini artırıyor. Ayrıca, yapılan detaylı dışarıdan inceleme (ex vivo) dağılım çalışmaları, KLG-3’ün vücutta tutulma ve temizlenme dinamiklerini ortaya koydu. Elde edilen veriler, terapötik amaçla lutetium-177 (^177Lu) radyoizotopuyla konjuge edilmiş ilgili türevler için dozimetri hesaplamalarında kritik rol oynuyor. Böylece hem tanı hem de tedavide bütünleşmiş bir yaklaşım mümkün oluyor.
KLG-3’ün glioblastoma dışında melanom tedavisinde de test edilmesi, bu antikor platformunun çeşitli IL13Rα2 pozitif kanser türlerinde tutarlı hedefleme ve uygun farmakokinetik özellikler sergilediğini doğruladı. Bu durum, bu tedavi ve tanı yöntemlerinin yalnızca tek bir tümör tipi ile sınırlandırılmaması, çoklu kullanım alanları bulması açısından dikkat çekici. Böylece, KLG-3 bazlı teknolojiler kanserli hastaların geniş bir yelpazesine uygulanabilir hale geliyor.
Yapılan ön dosimetri analizleri, ^177Lu-KLG-3 bileşiğinin düşük dozlarla dahi etkili tümör radyoaktif dozu verebileceğini ve yüksek terapötik indeksle ciddi yan etkileri azaltma potansiyelini ortaya koydu. Bu ilerleme, yüksek hassasiyetli tanı ve hedeflenmiş radyoterapi yeteneklerini bir araya getirerek, klinik pratikte büyük bir devrim yaratmayı hedefliyor. KLG-3, böylece çift amaçlı bir ajan olarak hem tümör görüntülemede hem de kanser tedavisinde önemli bir yer edinebilecek.
IL13Rα2’nin tümör mikroçevresinde bağışıklık baskılayıcı rolü göstermesi nedeniyle, KLG-3 tabanlı immuno-PET’in sadece tümör varlığını göstermekle kalmayıp, aynı zamanda IL13Rα2’nin immünolojik etkilerini anlamada ve bağışıklık sistemi yanıtlarını değerlendirmede de önemli bir biomarker işlevi görebileceği düşünülüyor. Bu sayede, immün modülasyon tedavilerinin kişiselleştirilmesi ve kombinasyon stratejilerinin geliştirilmesi yönünde önemli katkılar sağlanabilecek.
KLG-3’ün geliştirilmesi, moleküler hassaslıkla birlikte klinik uygulamaya yönelik uygulanabilirliği bir arada sunan yeni nesil theranostik tasarım anlayışını temsil ediyor. Önde gelen bilimsel merkezlerin ortaklığıyla geliştirilen bu antikorlar, laboratuvardan klinik ortama geçişte çok disiplinli bir çabanın sonucu olarak ön plana çıkıyor. Bu ortak çalışma, inovasyonun sadece teknolojik değil, aynı zamanda organizasyonel düzeyde de nasıl güçlendirilebileceğini gözler önüne seriyor.
Çalışmanın sonuçları, kanser araştırmaları ve klinik pratiği üzerinde derin etkiler yaratma potansiyeline sahip. Noninvaziv, gerçek zamanlı, yüksek özgüllükle çalışan IL13Rα2 görüntülemesi ve hedefe yönelik radyoterapi olanakları, kanser yönetiminde daha etkin ve daha az toksik yaklaşımları mümkün kılıyor. Yakın gelecek klinik denemeleri, KLG-3’ün insan hastalardaki etkinlik ve güvenlik profilini ortaya koyarak, bu yeniliğin rutin kullanıma girmesinde önemli rol oynayacak.
Yazarlar, bu çalışmanın yalnızca kanser görüntüleme ve tedavisinde değil, aynı zamanda IL13Rα2’nin şekillendirdiği tümörün immünolojik ortamının anlaşılmasında da önemli katkılar sağladığını vurguluyor. Bu kapsamda, KLG-3 ve benzeri antikorların kişiselleştirilmiş tıp uygulamalarında tanı, tedavi planlaması ve tedavi yanıtının değerlendirilmesinde vazgeçilmez araçlar haline gelebileceği öngörülüyor. Böylece, hastaya özel onkolojik stratejilerin geliştirilmesi ve uygulanması mümkün olacak.
Bu dönüm noktası niteliğindeki araştırma, IL13Rα2’nin kötü prognoz belirteci olmasının ötesinde, hedeflenebilir tedavi platformlarının merkezine oturmasını sağlıyor. Glioblastoma ve melanom gibi zor tedavi edilen kanserlerde hastaların yaşam kalitesini ve sağkalımını artırmayı amaçlayan bu yaklaşım, hassas onkolojide yeni bir sayfa açıyor. Araştırmanın bulguları, kanser tedavisindeki geleceğin vizyonunu somutlaştırırken, aynı zamanda bilimsel bilgi birikimini genişletiyor.
Özetle, KLG-3 ile tanımlanan bu yenilik, moleküler görüntülemeden terapötik müdahaleye uzanan kapsamlı bir strateji sunuyor. Klinikte kullanıma yönelik atılan bu birbirini tamamlayan adımlar, kanser hastalarının tanı ve tedavisinde etkinliği artırırken, yan etkileri minimize ederek klinik sonuçları iyileştirmeyi hedefliyor. Bu gelişmeler, önümüzdeki yıllarda onkoloji pratiğinde çığır açacak uygulamalara temel oluşturacaktır.
Araştırma Konusu:
Görüntüleme ve radyoterapi amaçlı IL13Rα2 hedefli antikorların geliştirilmesi ve katı tümörlerde preklinik değerlendirilmesi.
Makale Başlığı:
IL13Rα2-Targeting Antibodies for Immuno-PET in Solid Malignancies
Haberin Yayın Tarihi:
17 Nisan 2025
Web References:
https://doi.org/10.2967/jnumed.124.268762
Resim Credits:
Leah Gajecki ve ekipleri, Memorial Sloan Kettering Cancer Center, Sander Tri-Institutional Therapeutics Discovery Institute, The University of Texas MD Anderson Cancer Center
Anahtar Kelimeler:
Moleküler görüntüleme, moleküler hedefler, kanser araştırması, glioblastoma tedavi gelişmeleri, IL13Rα2 kanser biyobelirteci, KLG-3 antikor çalışması, melanom hedefli tedaviler, moleküler görüntüleme doğruluğu, yeni radyo-boyalı antikor, off-target toksisite azaltma, hassas onkoloji görüntüleme, preklinik antikor kanıtları, katı tümör tanısı, hedefe yönelik radyoimmünoterapi, üçlü negatif meme kanseri araştırması

























